Teoría de Lewis
 Gilbert Newton Lewis fue un fisicoquímico estadounidense reconocido por crear la estructura de Lewis o diagramas de punto. Famoso por su gran aporte a la fisicoquímica y más aún por ser inspiración para muchas mentes de la investigación tales como Linus Pauling.
Gilbert Newton Lewis fue un fisicoquímico estadounidense reconocido por crear la estructura de Lewis o diagramas de punto. Famoso por su gran aporte a la fisicoquímica y más aún por ser inspiración para muchas mentes de la investigación tales como Linus Pauling.
Desarrolló el estudio de los electrones periféricos de los átomos; fue el creador del término molécula impar y formuló la teoría del par electrónico para las reacciones de ácido.
La Teoría de Lewis
Ácidos y bases
 Dando la definición del comportamiento que puede presentar los ácidos y las bases, según Lewis las bases son ciertas especies que son capaces de donar electrones y los ácidos aceptarlos.
Dando la definición del comportamiento que puede presentar los ácidos y las bases, según Lewis las bases son ciertas especies que son capaces de donar electrones y los ácidos aceptarlos.
El ácido es un compuesto químico que dona catión hidrógeno (H+) a otro compuesto que en su caso es la base. Un ejemplo de ello es el ácido acético (el vinagre), ácido sulfúrico (usado en baterías de automóvil).
El ácido tiene una composición de electrones incompletos y la base posee electrones solitario, existen asidos denominados como (ácidos de Lewin) que producen reacciones orgánicas importantes.
Los patrones que sigues los ácidos de Lewis son identificados por tener un vacío el orbital 1s. Los ácidos son divididos a su vez como ácidos fuertes y débiles, mientras que las bases son divididas de la misma forma.
Esta teoría determina que las características de los ácidos y las bases no involucran transferencia de protón; pero si de electrones a diferencia de los ácidos – bases de Bronsted que son transferencia de protones.
Ácidos fuertes y débiles
Los ácidos fuertes ceden protones y pueden llegar a ser ser disueltos, si el disolvente tiene poca fuerza este no será aceptado de las misma manera y son denominados ácidos débiles.
Los ácidos fuertes se disocian fácilmente en agua mientras que los ácidos débiles son todo lo contrario; los ácidos débiles no causan daños las concentraciones bajas, pero si buscamos el ejemplo del vinagre este puede causar quemaduras.
Bases fuertes y débiles
- Las bases captan los protones cuando el disolvente es fuerte al cederlos y de esta manera son bases fuertes, si el disolvente tiene poca capacidad para cederlos actuará como débil.
- Las bases fuertes se disocian completamente de los iones, son bases de metales alcalinos y pueden llegar a ser corrosivas; por otra parte las bases débiles no se disocian con el agua, tal como el amoniaco.
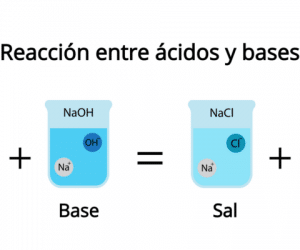
Reacciones entre ácidos y bases
La reacción que producen los ácidos junto con las bases es llamada neutralización. Cuando en una reacción está presente un ácido fuerte con una base fuerte se obtiene sal y agua.
En una reacción débil se produce en una neutralización es producida en una disolución acuosa se obtendrá una especie conjugada. Las neutralizaciones son combinaciones de iones hidrógeno y iones hidróxidos.
Valoraciones de los ácidos y las bases
 Se permite conocer la valoración que puede existir entre un ácido y una base al momento de la disolución; se mide el volumen de ambos. Cuando se valora un ácido lleva por denominación acidimetrías y las bases alcalimetrías.
Se permite conocer la valoración que puede existir entre un ácido y una base al momento de la disolución; se mide el volumen de ambos. Cuando se valora un ácido lleva por denominación acidimetrías y las bases alcalimetrías.- El punto de equivalencia es cuando ambos son iguales; es decir existe un equilibrio en su sustancia valorada, en este punto puede ser detectado con un indicador. Es una técnica utilizada para conocer la concentración.
- Aunque se existan diferencias se conoce una imponente manifestación al momento de su análisis, cuando son aplicadas en especie; ya sean líquidas o gaseosas o cuando su reacción pueda ser poco evidente.
- Cuando se mezcla un ácido fuerte con una base fuerte la especie quedará en una disolución mayor, si se realiza lo contrario dependerá la constante acidez y las concentraciones.
- Se obtendrá una disolución básica cuando esté presente un ácido débil y una base fuerte; por lo tanto si esto sucede la base permanecerá en la reacción. Existen definiciones alternativas y aplicaciones en las disoluciones.

También te puede interesar...