Configuración electrónica del Itrio
Este elemento es una tierra rara de transición, pertenece al grupo IIIB. Es un metal de tonalidad plateada y es común en los minerales que tienen las tierras raras.
Dos de los compuestos de este elemento se usan para crear la tonalidad roja que compone a los ledes o diodos luminiscentes empleados en los visualizadores de televisores CRT o a color de rayos catódicos.
Configuración Electrónica del Itrio

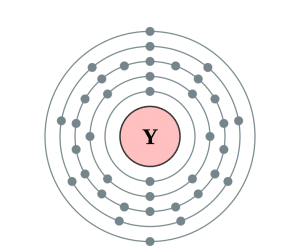
Este elemento está compuesto por 39 electrones y se distribuye de la forma siguiente: la primera capa contiene 2 electrones, la segunda posee 8 electrones, en la tercera capa se encuentran 18 electrones, la cuarta capa tiene 9 electrones, la quinta capa sólo posee 2 electrones.
El radio covalente del itrio es de 162 pm, el radio de Bohr o radio atómico es igual a 212 pm y el radio medio de este elemento es de 180 pm.
Para conocer la masa atómica que un elemento tiene, se debe saber cual es la masa completa de los protones y neutrones que se encuentran en un único átomo que forme parte de dicho elemento. En el caso del itrio, su masa atómica es de 88,90585 u. Este elemento está ubicado en el período 5 y en el grupo 3 de la tabla periódica de los elementos químicos.
Características y Propiedades de la configuración del Itrio
El itrio es un metal de tonalidad plateada, es ligero, brillante, maleable y dúctil. En su estructura química, es parecido a los lantánidos. Es muy estable cuando está en el aire porque arde cuando se encuentra por encima de los 600 grados Kelvin. Es reactivo en algunas condiciones. Las virutas del metal y su polvo pueden encenderse cuando se hallan en temperatura ambiente.
Este elemento es la tierra rara de mayor abundancia pero de difícil extracción. Puede ser creado a través de la fisión nuclear. Se asocia a los elementos ubicados en el 57 al 71.
En su forma natural este elemento se encuentra en estado sólido. Su símbolo atómico es Y, su número atómico es 39. El punto de ebullición corresponde a 3336,85 grados centígrados o grados Celsius, lo que es igual a 3609 grados Kelvin. El punto de fusión es de 1526,85 grados centígrados o grados Celsius, similar a 1799 grados Kelvin.
Obtención y Presencia del Itrio
- Los metales raros pueden obtenerse gracias a métodos de intercambio iónico o disolvente. El itrio comercial es obtenido reduciendo el fluoruro junto al calcio a manera de óxido de itrio, éste se obtiene de la gadolinita que al mismo tiempo está compuesta por erbio, gadolinio, holmio, europio y renio.
- Este mineral se ubica en Suecia, Groenlandia, Noruega, Japón y Colorado. De igual forma, el itrio puede hallarse en el mineral nuevita, este es común en el área de Colorado. Este mineral se compone de tantalio, titanio, cuarzo y hierro, es parecido al keilhauite el cual se encuentra en Noruega.
- La fergusonita se conoce como un mineral de tonalidad café, esta se fractura de manera vítrea. Se halla en los montes Apalaches desde Carolina del Sur hasta Nueva Inglaterra. Es un tantalato y columbato de cerio con itrio, uranio y erbio.
Isótopos del Itrio
El itrio natural está compuesto únicamente de un isótopo el cual es Y-89. Los radioisótopos de mayor estabilidad son Y-88 con un período de semidesintegración igual a 106,65 días y el Y-91 que posee 58,51 días.
Los demás isótopos poseen períodos de semidesintegración menor a un día, a excepción de Y-87 que contiene uno igual a 79,8 horas. Se tienen registrados 26 isótopos con inestabilidad. El ion Y3+ se considera diamagnético.
Precauciones con el Itrio
Este elemento es de peligro en el ambiente laboral porque los gases y las partículas pueden ser inhaladas cuando se encuentran en el aire. El itrio puede generar daño en los pulmones, básicamente cuando existen exposiciones durante mucho tiempo.
También es posible que produzca cáncer en las personas y eleve las posibilidades de sufrir cáncer de pulmón cuando se inhala. Si se acumula en el organismo humano, puede ser una amenaza para la salud del hígado.

Vea también...