Configuración electrónica del Iridio
Constituye ser el segundo elemento de mayor densidad luego del osmio y el de mayor resistencia a la corrosión, aún en temperaturas tan elevadas como los 2000 grados Celsius. Únicamente algunas sales fundidas y halógenos tienen mayor corrosión para el iridio cuando está en estado sólido. El elemento en polvo tiene mayor reactividad y puede ser inflamable.
Se descubrió en 1803 partiendo de las impurezas insolubles encontradas en el platino natural. Este elemento es uno de los más raros en la corteza de la tierra, su consumo y extracción anual es de sólo 3 toneladas.
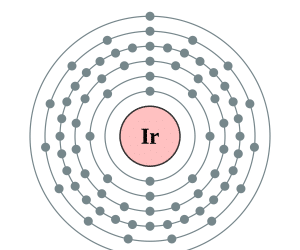
Configuración Electrónica del Iridio
La configuración electrónica de los elementos de la tabla periódica permite conocer la estructura de los electrones ubicados en los átomos de cualquier elemento. La configuración electrónica completa del iridio es 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p6 4f14 5d7 6s2 y la configuración electrónica abreviada o simplificada del mismo elemento es [Xe]4f14 5d7 6s2.
La masa atómica de cualquier elemento es definida gracias a la masa completa de los protones y los neutrones ubicados en el átomo del elemento. La masa atómica que tiene el iridio es de 192,217 u. Este elemento es ubicado en el período 6 y en el grupo 9 de la tabla periódica de los elementos químicos.
El radio covalente del iridio es de 137 pm, el radio medio es igual a 135 pm y el radio de Bohr o radio atómico de este elemento es de 180 pm.
Principales características de la configuración del Iridio
El iridio es de tonalidad blanca, similar al platino, tiene una ligera tonalidad amarilla. Es complicado trabajar con este metal porque es muy quebradizo y duro. Es el metal de mayor resistencia a la corrosión, no sufre ataques por ácidos ni por el agua regia tampoco. Para ser disuelto, se utiliza ácido clorhídrico junto a una concentración de clorato de sodio a temperaturas muy elevadas.
Comúnmente el iridio se considera como un metal extraterrestre porque solamente es común en los meteoritos y rara vez se encuentra en la corteza terrestre, lugar donde solamente existe una concentración pequeña de 0,001 ppm. Este metal es el de mayor densidad luego del osmio. Se tiene por entendido que el núcleo del planeta está compuesto por este metal y por el níquel y el hierro, los cuales son sus compuestos de mayor importancia.
El iridio es sólido en su estado de forma natural. Como se ha mencionado antes, es plateado y blanco, forma parte del grupo de los metales de transición, su símbolo químico representativo es Ir y su número atómico es igual a 77. El punto de ebullición de este elemento es de 4428,85 grados centígrados o grados Celsius, esto es similar a 4701 grados Kelvin. El punto de fusión es de 2466,85 grados centígrados o grados Celsius, similar a 2739 grados Kelvin.
Precauciones con el Iridio
El iridio que encontrado en forma de no metal no representa peligro para la salud porque tiene poca reactividad en los tejidos, solamente existen 20 partes por trillón de este elemento en los tejidos del cuerpo humano. A pesar de esto, el polvo que se encuentra dividido finalmente sí es peligroso de manipular porque irrita y puede inflamarse en contacto con el aire.
Se tiene poca información sobre la toxicidad que caracteriza a los compuestos de iridio porque este metal es escaso y sus compuestos se usan en cantidades sumamente pequeñas. Sin embargo, las sales solubles como los haluros de iridio pueden representar un peligro a causa de los demás elementos que existen en el compuesto.
La gran parte de los compuestos de la configuración electrónica del iridio tienen características insolubles, esto hace difícil la absorción involuntaria de los compuestos a través del cuerpo humano. El Ir192 es un radioisótopo de iridio es peligroso como cualquier isótopo radiactivo, los únicos reportes que se relacionan a lesiones por este elemento están conectados a la exposición accidental de este radioisótopo empleado en la braquiterapia.
Las radiaciones altas de rayos Gamma que tienen gran energía a causa de este radioisótopo pueden aumentar el riesgo de padecer cáncer. La exposición externa puede producir envenenamiento por radiación, quemaduras y finalmente la muerte. Ingerir Ir192 puede llevar a quemar el revestimiento de los intestinos y del estómago. El Ir194m, Ir192m y el Ir192 normalmente se acumulan en el hígado y pueden causar riesgos sanitarios por radiación beta y por radiación Gamma.


Vea también...