Configuración electrónica del Rutenio
Su densidad es de 12370 kg/m3 y su peso atómico es de 101.07. Es uno de los metales de transición y de poca abundancia. Es hallado en las minas de platino normalmente.
Se caracteriza por ser un metal manejable con dificultad solo temperaturas altas, es blanco grisaceo y duro. Se utiliza como un catalizador en algunas aleaciones de platino, en reacciones de oxidación, hidrogenación, reformación e isomerización.
Es eficaz para endurecer el paladio y el platino. En aleaciones con otros metales preciosos con porcentajes grandes, de 30-70 por ciento, se usa en aplicaciones que necesitan resistencia a la corrosión extrema, al agua y contactos eléctricos.
Configuración electrónica simplificada del rutenio

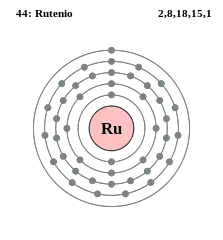
De acuerdo a su configuración electrónica, estos están repartidos de la siguiente manera:
- 2 electrones en la órbita 1s
- 2 electrones en la órbita 2s
- 6 electrones en la órbita 2p
- 2 electrones en la órbita 3s
- 6 electrones en la órbita 3p
- 10 electrones en la órbita 3d
- 2 electrones en la órbita 4s
- 6 electrones en la órbita 4p
- 7 electrones en la órbita 4d
- 1 electrón en la órbita 5s
- Sus electrones por nivel son: 2, 8, 18, 15, 1.
Isótopos del Rutenio
Del rutenio se pueden hallar un total de siete isótopos en la naturaleza. De todos ellos, los radioisótopos con mayor estabilidad son el 106Ru, suyo periodo de semidesintegración es de 373,59 días, el 97Ru, que se desintegra en 2,9 días y el 103Ru que tarda 39,26 días en desintegrarse. Su configuración electrónica es Kr 4d7 5s1.
Además, existe un total de quince radioisótopos con pesos atómicos que van desde 89,93 uma como el 90Ru hasta 114,928 uma en el caso del 115Ru.
La mayoría de ellos se desintegran en un periodo menor a los cinco minutos, excepto en el caso del 95Ru, que tarda 1,643 horas en desintegrarse, y el 105 cuyo tiempo de desintegración es de 4,44 horas.
Efectos del Rutenio en la salud
Los compuestos del rutenio es raro encontrarlos y a todos se les debe considerar altamente tóxicos y carcinógenos. Entre las consecuencias que pueden tener en la salud es que manchan la piel, aparentemente porque cuando este elemento se ingiere es retenido en los huesos con gran fuerza. Se debe evitar a toda costa el contacto con el óxido de rutenio ya que es muy volátil y tiene un muy elevado grado de toxicidad.
En el año 1945 fue utilizado el rutenio 106 como uno de los radionucleidos implicados en las pruebas atmosféricas de armas nucleares, este se comenzó probando en Estados Unidos y terminó siendo probado en China en el año 1980.
El tetraóxido de rutenio puede explotar, por lo que tiene mucha semejanza con el tetraóxido de osmio. Es un radio radionucleido de vida larga y este tipo de compuestos seguirán produciendo un aumento en el riesgo de padecimientos de canceres durante los siglos por venir. Hasta el momento no ha sido posible la documentación de los efectos negativos en el medio ambiente que puede causar el rutenio.
Obtención y abundancia del rutenio
El rutenio se halla en pocos minerales y estos no son comerciales, como, por ejemplo, la laurita, la platarsita y la anduoita. Además, es posible encontrarlo en cantidades mínimas en la pentlandita. Normalmente se encuentra con otros elementos del grupo del platino, con aleaciones, en América y los Urales.
Compuestos del Rutenio
Entre los compuestos del rutenio se encuentran diversos estados de oxidación, pudiendo alcanzar el +8, sin embargo, de este elemento los más comunes son +2, +3 y +4. Es posible usar algunos complejos de Ru+2 y Ru+3 para tratar el cáncer. El compuesto tetraóxido de rutenio (RuO4), es muy oxidante y su descomposición de realiza de forma muy violenta a elevadas temperaturas.
Elementos relacionados con el Rutenio
Entre los elementos que guardan relación con el rutenio, ya sea debido a su aproximación en el número atómico, porque se encuentran en el mismo grupo o por el periodo están el Rodio, hierro, tecnecio y osmio.

Vea también...