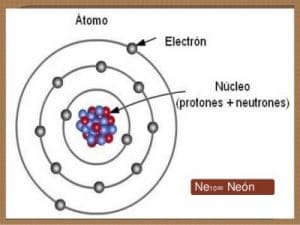
Configuración electrónica del Neón
Es muy abundante en el universo, provee un color rojizo que caracteriza a la luz que tienen las lámparas fluorescentes en las cuales es usado. El neón es el segundo gas noble de mayor ligereza.
Tiene un poder de refrigeración 40 veces más grande, por unidad de volumen, que el del helio líquido y 3 veces más grande que el que tiene el hidrógeno líquido. En casi todas las aplicaciones, la utilidad del Neón líquido cuesta más que la del helio debido a que es más difícil y raro de obtener.
Configuración Electrónica del Neón
Propiedades del Neón
- Su punto de ebullición es igual a −246 °C, es decir 27,10 K.
- Su peso atómico es 20,180 u.
- Su densidad es igual a 1,207 g/cm³ a −246 °C, o en otras palabras 1,20 g/ml.
- Su punto de fusión es igual a −248,6 °C o 24,56 K.
Aplicaciones del Neón
El color anaranjado y rojo que emite la luz de los tubos de neón se usa básicamente para los anuncios publicitarios. También se les llama tubos de neón de otro color a los que contienen distintos gases.
- Indican el alto voltaje.
- Se usa como rótulo luminoso.
- Se obtiene un tipo de láser usándolo junto al helio.
- En los tubos de la televisión.
- El Neón líquido se emplea en vez del nitrógeno líquido para refrigerar.
- El Neón licuado se vende como refrigerante criogénico.
Obtención y Abundancia
El neón básicamente se obtiene en forma de gas. En la atmósfera terrestre se tiene un 65,8 ppm, se consigue gracias a la cristalización de líquido biocompuson y al subcalentamiento del aire que resulta del gas. Este es el quinto elemento de mayor abundancia en el universo por su masa, después del helio, hidrógeno, carbono y oxígeno.
Se encuentra en cantidades pequeñas en la atmósfera mientras que hay una proporción de 0,005 ppm en la corteza terrestre. El neón puede sintetizarse en estrellas masivas mientras ocurren las últimas etapas de las gigantes o supergigantes rojas, en las que se realiza la fase de fusión de oxígeno y carbono en magnesio y neón. O también en las estrellas Wolf Rayet y en las variables azules luminosas.
Efectos del Neón en la Salud
Riesgos al inhalar el gas
Si se pierde el líquido en su contenedor, éste se evapora muy rápido y provoca sobresaturación del aire con un alto peligro de asfixia en recintos cerrados.
Vías de exposición del gas
El cuerpo puede absorber a la sustancia a través de la inhalación.
Inhalación
Es un gas inerte, se clasifica como asfixiante simple. En concentraciones masivas de inhalación puede provocar náuseas, mareos, pérdida de conciencia, vómitos y hasta la muerte. La muerte puede ser el resultado de confusión, errores de juicio, pérdida de la conciencia, entre otros. En concentraciones bajas de oxígeno, la muerte o la pérdida de conciencia pueden suceder en cuestión de segundos sin dar advertencias.
Síntomas
Los primeros síntomas que producen el asfixiante simple son hambre de aire y respiración rápida. Se minimiza la alerta mental y se perjudica la coordinación muscular. Todas las sensaciones son deprimidas y el juicio se hace imperfecto. Usualmente se presenta la fatiga y la inestabilidad emocional. A medida de que progresa la asfixia se presentan los vómitos, las náuseas, la pérdida de conciencia y la postración. Al final las convulsiones, un coma profundo y la muerte.
Efectos de la exposición
En la piel se produce una congelación cuando el líquido entra en contacto, también en los ojos. El asfixiante simple se presenta en la inhalación.

Vea también...