Configuración electrónica del Argón

Es inerte e incoloro, compone el 0,934% de todo el aire seco. Su nombre se origina de la palabra griega “argos”, la cual significa inactivo. Esto se debe a que este elemento no tiene reacción.
El argón se utiliza como gas de relleno para las lámparas incandescentes porque éste no tiene reacción con el material del cual se compone el filamento, aún cuando se encuentra a una alta presión y temperatura, esto permite que la vida útil de la bombilla se prolongue. Este elemento se usa como sustituto del neón en las lámparas fluorescentes cuando se quiere tener una tonalidad azul y verde en lugar del característico rojo del neón.
Este elemento químico fue descubierto en el año 1894 por las investigaciones del físico John Strutt Lord Rayleigh y el químico Sir William Ramsay, quienes aislaron el gas a través de un estudio del residuo que se obtuvo con la eliminación del oxígeno, el nitrógeno y el dióxido de carbono del aire. Su nombre proviene de la palabra griega “argos” que quiere decir “inactivo” lo cual describe su inercia química.
Es incoloro, inodoro y en su forma natural se muestra en estado gaseoso. Es el tercer miembro del grupo de los gases nobles, raros o inertes de la tabla periódica, también distinguido como grupo 0. A pesar de estar dentro de este grupo, no se le considera como un elemento raro. Muy pocas veces participa en reacciones químicas y siempre se muestra con una reactividad química muy baja en condiciones normales.
Aunque este gas se encuentra en grandes cantidades en la atmósfera de la Tierra, siendo el tercer gas más común en esta capa terrestre, después del nitrógeno y del oxígeno, también se ha encontrado trazas de este elemento en meteoritos y minerales.
Configuración Electrónica del Argón
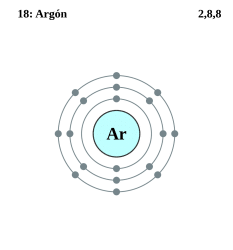
El número atómico del argón es 18, lo que significa que su configuración electrónica completa es la siguiente: 1s22s22p63s23p6, mientras que su versión simplificada o abreviada se escribe como: [Ne]3s23p6.
En el caso del argón, su radio de Bohr o radio atómico es de 71 pm, mientras que su radio de Van Der Waals es igual a 188 pm y su radio covalente tiene 97 pm.
Este elemento se compone por 18 electrones en total. La distribución de los mismos se hace de la siguiente manera: en la primera capa se encuentran 2 electrones, en la segunda se ocupan 8 electrones y finalmente en la tercera capa existen 8 electrones también.
Para realizar la configuración electrónica de los elementos se hace uso de principio de Aufbau. Este consiste en que los electrones se colocan tomando en cuenta el nivel creciente de energía que poseen los orbitales. De acuerdo a este principio lo primero que se determina es el número atómico del elemento y después los electrones se han de llenar siguiendo el orden sucesivo.
En el orbital s la cantidad máxima de electrones corresponde a 2, en el orbital p el máximo número para llenar electrones es 6, en el orbital d el número más alto de electrones es 10 y en el orbital f esta cantidad corresponde a 14.
¿Cuál es su distribución electrónica del Argón?
[Ne]3s23p6
Propiedades del Argón
El argón es un gas noble, presenta una tendencia baja para ser partícipe de reacciones químicas. Este elemento, como sucede con los demás gases nobles, tiene distintas propiedades que lo caracterizan. Estas son:
- Es inodoro, incoloro y su reactividad química está en un nivel muy bajo a condición normal.
- En su forma natural, el estado del argón es gaseoso.
- El argón forma parte de los gases nobles, uno de los grupos pertenecientes a la tabla periódica.
- Este elemento se representa por el símbolo químico Ar, mientras que su número atómico es 18.
- El punto de ebullición de este elemento es de -184,85 grados centígrados o grados Celsius, lo que es igual a 87,3 grados Kelvin.
- El punto de fusión del argón es de -188,35 grados centígrados o grados Celsius o 83,8 grados Kelvin.
- Presenta una lenta reacción, lo cual le aporta una excelente capacidad de inertización. Esto le hace ser un gas perfecto para emplearlo en soldadura y metalurgia con arco eléctrico.
- No es tóxico.
- Es inodoro e incoloro en su estado gaseoso y líquido.
- Es un gas muy inerte.
- Su estado ordinario es gas.
- Sus principales isótopos en la Tierra son Ar-40 (99,6%), Ar-36 uy\\y Ar-38.
- Su masa atómica se determinada por la masa total de protones y de electrones que se encuentra en un solo átomo.
- Tiene una gran variedad de purezas y mezcla tanto en estado líquido como en gaseoso.
- Junto al nitrógeno y al oxígeno son los principales gases que se extraen de la atmósfera terrestre.
- El Argón es de gran importancia es procesos de fabricación de productos llegando a compararse con la electricidad y el agua.
Obtención y Abundancia del Argón
Este gas es obtenido gracias a la destilación fraccionada realizada en el aire licuado, en éste se ubica una proporción de un aproximado del 0,94 % y después de la eliminación del oxígeno residual junto al hidrógeno. La atmósfera del planeta Marte tiene un 5 ppm de Ar36 junto un 1,6 % de Ar40. En el planeta Venus se encuentran trazas de este elemento mientras que en Mercurio existe un 7%.
En agosto del 2014, la Agencia Espacial Europea usó a la sonda Rosetta y gracias a su instrumento Rosina pudo detectar a los isótopos a Ar38 y Ar36 en la coma del cometa llamado 67P.
¿Cómo se obtiene y/o produce el Argón?
Este gas se obtiene en la naturaleza y con el fraccionamiento del aire líquido. Se consigue al destilar de forma fraccionada el aire licuado, en el cual se llega a encontrar en una proporción de unos 0.94 % aproximadamente, y se elimina el oxígeno residual con hidrógeno.
Isótopos del Argón y configuración de electrones
Los isótopos principales de este elemento que pueden ser encontrados en el planeta Tierra son el Ar38, el Ar36 y el Ar40, del cual existe 99,6%. El isotopo K40 tiene un período de semidesintegración igual a 1205x109 años. Con estos ratios de desintegración es posible conocer la edad que tienen las rocas.
En la atmósfera de la tierra, el Ar39 se produce gracias al bombardeo de rayos cósmicos básicamente partiendo del Ar40. En zonas subterráneas que no tienen exposición, este es producido por la captura neutrónica del K39 junto a la desintegración α del Ca37.
El Ar37 tiene un período de semidesintegración igual a 35 días, es el resultado del decaimiento del Ca40, que al mismo tiempo es producto de las explosiones subterráneas nucleares.
Características del Argón
- Está situado en la posición número 18 de la tabla periódica con el símbolo químico Ar y una masa atómica de 39,948 g/mol.
- Su configuración electrónica es [Ne]3s23p6 .
- Tiene un radio covalente de 1,74.
- Su primer potencial de ionización es 15,80.
- Presenta una densidad de 1,40.
- Su punto de fusión es de -189,4 y de ebullición de -185,8 grados Célsius.
- Se encuentra en el periodo 3 de la tabla periódica.
- Tiene en total 18 electrones de los cuales 8 se encuentran en la tercera capa, 8 en la segunda capa y los 2 electrones restantes están en la primera capa.
- Presenta un radio de Bohr o atómico de 71pm.
- Su radio de Van de Waals es de 188 pm y el covalente es de 97 pm.
Uso del Argón
El argón se emplea en diferentes sectores, como en metalurgia, en la industria farmacéutica, el soladura y corte, automoción y transporte, en laboratorios y análisis, y en el sector de la alimentación.
- Empleado en quemadores eléctricos de grafito, ya que evita que el grafito combustione.
- Se puede utilizar para apagar incendios.
- Se usa como gas de relleno en lámparas incandescentes,
- Se emplea para descarburar el acero.
- Se usa para fabricar cristales de germanio y de silicio.
- Se emplea en la datación de núcleos de hielo.
- Este gas es el que se emplea en la elaboración del láser azul. Es muy utilizado en cirugías, ya que las luces de láser azul es perfecta para soldar arterias y solucionar problemas de la vista.
- Se emplea para preservar barnices, pinturas y demás líquidos que requieran de preservantes después de abiertos.
- En su estado líquido se puede emplear para eliminar células cancerígenas a través de un procedimiento conocido como coagulación con argón.
- Usado para inflar los trajes seco de los buzos,
- Con este gas es que se sacrifican a los cerdos cuando hay un brote de alguna enfermedad, lo cual será indoloro para estos animales.

Vea también...