
El número atómico está representado por la letra Z; muchos atribuyen el origen de esta denominación(“Z”) como proveniente de la palabra alemana Atomzahl cuyo significado es número atómico, aunque antes del año 1915, solo se usaba la palabra Zahl “número” para el número asociado a cada elemento de la tabla periódica.
El número atómico es característico de cada elemento de la tabla periódico a excepción del hidrógeno -1.
El número atómico
¿De qué se encarga el número atómico?
Características del número atómico
- Es un término que sirve para indicar el número de electrones existentes en la corteza de un átomo.
- El ordenamiento en cuanto al elemento y el lugar que este ocupa en la tabla periódica deriva del mismo concepto.
- La autenticidad de un átomo está determinada por el número atómico.
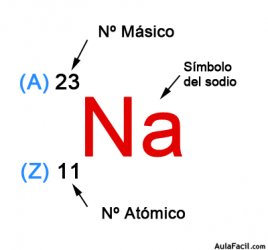
- El número atómico es colocado en la parte izquierda del elemento que representa, debajo del número másico, representado por la letra A, por ejemplo: Na, corresponde al elemento Sodio, con un número atómico 11 y un número másico de 23.
- Determina las características químicas de un elemento.
- Una característica del número atómico que se ve refleja en la tabla periódica, es que este también define el nivel de llenado de los posteriores orbitales del átomo. Es conveniente tener en cuenta que un átomo no alterado es eléctricamente neutro y por tanto su número atómico siempre será equivalente a su número de electrones.
Propiedades químicas
Como planteamos recientemente, el número atómico es quien determina las propiedades químicas de un elemento.
Ustedes se preguntarán: ¿Cómo es que el número atómico determina esto? Bueno, como resultado del número de electrones presentes en el átomo neutro, que en realidad es el mismo número atómico, cada elemento tiene un conjunto propio de propiedades químicas.
Recuerden que la configuración de dichos elementos siguen los principios de mecánica cuántica y el factor primordial en la determinación de su comportamiento de unión química es el número de electrones acumulados en cada elemento, especialmente los de la capa de valencia más externa.
Evolución del número atómico y tabla periódica
Alrededor del año 1911, Antonius Johannes van den Broek, un físico amateur de origen holandés, se dio cuenta que el número atómico, anteriormente denominado número de un elemento de la tabla periódica, correspondía a la carga de su núcleo atómico.
Luego de la publicación de esta hipótesis, Henry Gwyn Jeffreys Moseley (físico y químico inglés), dio una justificación cuantitativa respecto al concepto de número atómico, mediante una ley a la cual le adjudicó su nombre, llamando este aporte a la ciencia como Ley de Moseley.
Esta es una ley de carácter empírico, enunciada en el año 1913, en la que se establece una relación organizada o sistemática entre la longitud de onda de los rayos x emitidos por los diferentes átomos y el número total de protones que tenía cada átomo de dicho elemento, es decir, establecía una conexión entre el número atómico y la longitud de onda de los rayos x que emitían esos átomos.
El aporte de Moseley fue de gran importancia ya que en ese momento no se tenía la información que hoy se tiene sobre el número atómico. Pues hasta ese momento, dicho número sólo era el lugar que ocupaba un elemento en la tabla periódica de los elementos y estaba relacionado en forma cuantitativa con las masas atómicas y las propiedades de los elementos.
La Ley Moseley establece que las propiedades químicas y físicas de los elementos químicos tienen una tendencia a repetirse de forma sistemática según aumenta el número atómico; es la base de la tabla periódica.
Tabla periódica
Se le atribuye a Dmitri Mendeléyev, un químico ruso (conocido por haber descubierto la tabla periódica de los elementos, que anteriormente se le llamaba el platón subyacente y de acuerdo a las variaciones de las propiedades químicas, el responsable de ordenar los elementos). No obstante, fue Julius Lothar Meyer (químico alemán y contemporáneo de Mendeléyev) el haber concretado la organización de la tabla periódica según las propiedades físicas de los átomos.
No se puede olvidar el importante papel ejercido por Moseley en el 1913 donde se contrarrestaban las propuestas de Mendeléyev establecida cuatro décadas antes.

