Configuración electrónica del Silicio

Es presentado en forma cristalizada y amorfa. En su forma amorfa se parece a un polvo parduzco, tiene mayor actividad que la variante cristalina. Su apariencia es en octaedros de tonalidad grisácea y azul junto a un brillo metálico.
Configuración Electrónica del Silicio
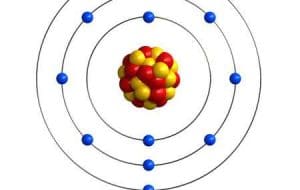
Con la configuración electrónica de cada elemento es posible definir la manera en la que se estructuran los electrones en los átomos que tiene un elemento, en este caso el silicio. El radio de Bohr o radio atómico es de 111 pm, el radio medio es igual a 111 pm, el radio de Van der Waals es de 210 cm y su radio covalente es de 111 p m.
El silicio posee un total de 14 electrones, su distribución se da de la siguiente forma: la primera capa posee 2 electrones, en la segunda hay 8 y la tercera se compone de 4 electrones.
Propiedades del Silicio
Las propiedades del silicio son intermedias entre las del germanio y las del carbono. En su apariencia cristalina tiene poca solubilidad, mucha dureza, tonalidad grisácea y un brillo metálico. Es un elemento relativamente inerte, puede resistir la acción de casi todos los ácidos, tiene reacción con los álcalis diluidos y con los halógenos. El silicio puede transmitir más del 95% de las longitudes de onda que tiene la radiación infrarroja.
El silicio es preparado a manera de polvo pardo amarillo o de cristales grisáceos y negros. Se consigue al calentar dióxido de silicio o sílice junto a un agente reductor, el cual puede ser magnesio o carbono dentro de un horno eléctrico. La dureza del silicio cristalino es de 7, puede rayar el vidrio. El punto de fusión del silicio es 1.411 grados centígrados, su densidad relativa es de 2,33(g/ml) y su punto de ebullición es igual a 2.355 grados centígrados. Su masa atómica es igual a 28,086 u.
El silicio forma parte del 28% de la corteza de la Tierra, no se encuentra en estado libre sino en forma de silicatos complejos y dióxido de silicio. Los minerales que están compuestos de silicio son cerca del 40% de cada mineral común, incluyendo el 90% o más de los minerales que crean a las rocas volcánicas. El mineral cuarzo junto a las variedades crisoprasa, cornalina, pedernal, ónice y jaspe junto a los minerales tridimita y cristobalita son las formas cristalinas que tiene el silicio en la naturaleza.
El dióxido de silicio es el principal componente de la arena. Los silicatos junto al calcio, aluminio y magnesio son los principales componentes del suelo, arcillas y rocas a manera de anfíboles, feldespatos, micas, zeolitas y piroxenos. También de las piedras semipreciosas tales como granate, olivino, topacio, circón y turmalina.
Usos del Silicio
El silicio es usado en la decantación de las siliconas, en aleaciones y en la industria de la cerámica técnica. Este material es un semiconductor de gran abundancia, por lo tanto se emplea en la industria microelectrónica y electrónica como material base para crear chips u obleas que se implanten en pilas solares, transistores y una enorme variedad de circuitos electrónicos.
El silicio es un elemento de importancia en muchas industrias. El dióxido de silicio es un constituyente importante de los ladrillos y del hormigón, se usa en la producción del cemento Portland. Debido a sus propiedades semiconductoras también se emplea en la fabricación de células solares, transistores y toda clase de dispositivos semiconductores.
Contenido del artículo

Vea también...