Configuración electrónica del Platino
Es un metal de transición de tonalidad grisácea y blanca, es pesado, precioso, dúctil y maleable. Resiste la corrosión y se halla en diferentes minerales, comúnmente en cobre y el níquel, también puede ser encontrado a manera de metal. Se utiliza en joyería, contactos eléctricos, equipamiento de laboratorio, catalizadores de automóviles y empastes.
Se encuentra en minas pertenecientes a rocas ígneas que tienen gránulos de pequeño tamaño. La producción de platino alrededor del mundo está estimada en unas 16 toneladas al año repartidas básicamente en Colombia, Sudáfrica, Estados Unidos, Canadá y países de la desaparecida Unión Soviética.
Usualmente es hallado en estado metálico aleado junto a otros metales de su mismo grupo a manera de escamas y pepitas. Se asocia a los minerales de cobre, níquel y cromo principalmente.
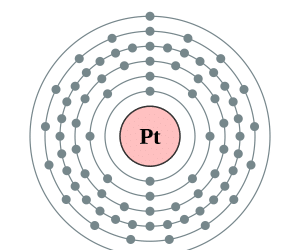
Configuración Electrónica del Platino

Como mencionamos al inicio de este tema: la configuración electrónica completa del platino es 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p6 4f14 5d9 6s1 y su versión abreviada o simplificada es [Xe]4f145d96s1.
El radio de Van Der Waals de este elemento es de 175 pm, el radio covalente es igual a 128 pm, el radio de Bohr o radio atómico corresponde a 177 pm mientras que el radio medio se conoce de 135 pm. Este elemento se encuentra en el grupo 10 de la tabla periódica de los elementos, específicamente en el período 6. La masa atómica del platino es de 195,078 u.
Características Básicas del Platino
- Cuando el platino se encuentra en estado puro es dúctil, maleable y de tonalidad grisácea y blanca.
- Resiste la corrosión y no se disuelve en la gran variedad de ácidos, aunque el agua regia si puede disolverlo convirtiéndolo en acido cloroplatínico.
- Cuando el platino se encuentra en contacto con el aire, es atacado de forma lenta por el ácido clorhídrico.
- Se le llama grupo del platino a los elementos osmio, rutenio, iridio, rubio, platino y paladio. Estos son muy empleados a manera de catalizadores.
- Ese elemento tiene resistencia relativa al ataque químico. Posee adecuadas propiedades físicas en altas temperaturas y sus propiedades eléctricas también son buenas, haciendo que sea utilizado en diferentes aplicaciones industriales tales como en contactos electrónicos a manera de electrodo.
- En contacto con el aire, el platino no se oxida pero puede tener reacciones tomando en cuenta las condiciones que existan con halógenos, cianuros, plomo, azufre, silicio y demás elementos; también en ozono y en algunos óxidos básicos fundidos.
Producción del Platino
En la actualidad, Sudáfrica tiene las más grandes reservas de platino en el mundo representando el 70% de la totalidad mundial, por lo tanto es el mayor exportador y productor. Canadá y Rusia tienen reservas modestas de platino mientras que Estados Unidos produce mínimamente el material, aunque tiene prácticamente la mitad de los yacimientos de Canadá. Rusia y Sudáfrica producen el 90% de la producción de platino en el mundo.
Isótopos del Platino
El platino natural Pt78 es producido en 5 isótopos estables los cuales son Pt194, Pt192, Pt196, Pt195 y Pt198. Tiene un radioisótopo de prolongada duración el cual es Pt190, la vida media de este es de 6.50 × 1011 años.
También existen 31 radioisótopos artificiales que se conocen, el de mayor duración de todos es Pt193, su vida media es igual a 50 años. Todos los otros isótopos poseen una vida media inferior a un año, casi todos a menos de un día.
Usos del Platino
- Tomando en cuenta su inercia química y su gran punto de fusión, el platino se usa aleado con el iridio para construir aparatos de laboratorio tales como platos de combustión, crisoles, pinzas, evaporadores, entre otros.
- Se usa en elementos calefactores, en contactores y en pares termoeléctricos para medir temperaturas altas.
- Se emplea en medicina y en joyería. En medicina para preparar rellenos dentales y drogas antitumorales.
- La esponja de platino dividida finamente se usa como catalizador en procedimientos tales como la producción de ácido sulfúrico, ácido nítrico, cracking de hidrocarburos y en metanal.
Precauciones con el Platino
A manera de metal el platino no representa mucho peligro, sin embargo sus sales pueden causar diferentes efectos tales como alteración del ADN, combustiones, reacciones alérgicas en la piel y en las mucosas, cáncer, daños en la audición y daños en órganos como los riñones, intestino y médula.
El platino también puede potenciar la toxicidad que tienen otros productos químicos que causan daños en el organismo humano, tales como el selenio.

Vea también...