Configuración electrónica del Plomo

Este químico no reconocía al plomo como un elemento común metálico debido a su enorme elasticidad molecular. Se destaca que la elasticidad de este elemento tiene presente la temperatura ambiente que se extiende a sus átomos.
El plomo se caracteriza por ser un metal pesado, su gravedad específica o densidad relativa es de 11,4 a 16 grados centígrados. Su tonalidad es plateada y azul, se empaña para obtener un color mate gris. Es inelástico, flexible y fácilmente fundible. Su fusión se crea a 327,4 grados centígrados y puede hervir a 1725 grados centígrados. Sus valencias químicas comunes son 4 y 2.
Tiene una resistencia relativa al ataque del ácido clorhídrico y ácido sulfúrico. puede disolverse lentamente en ácido nítrico y en bases nitrogenadas. Este elemento es anfótero debido a que crea sales de plomo en los ácidos y sales metálicas provenientes del ácido plúmbico. Puede crear diversas sales, compuestos organometálicos y óxidos.
Configuración Electrónica del Plomo
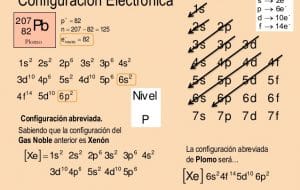
La configuración electrónica expresa la manera en la cual los electrones se distribuyen, se comunican, se estructuran y tienen organización entre ellos a través del modelo de capas electrónicas. Para crear la configuración electrónica se emplea el diagrama de Moeller en el cual se sigue el rastro hasta completar el número total de electrones.
Características del Plomo
Los compuestos de plomo más usados en la industria son los silicatos de plomo, los óxidos de plomo y el tetraetilo de plomo. El plomo crea aleaciones con diversos metales. Generalmente se usa esta forma en casi todas sus aplicaciones. Este elemento es un metal tóxico y pesado. La intoxicación por plomo se le llama plumbosis o saturnismo.
Efectos del Plomo
En la actualidad, la atmósfera es la más grande fuente de plomo. Aunque su contenido se está minimizando debido a la prohibición de usar gasolina con plomo. El plomo puede ingresar al agua potable gracias a la corrosión de las tuberías. Esto es más común cuando el agua es ácida ligeramente, por esta razón los sistemas de tratamiento de aguas deben ajustar el pH del agua potable. El plomo no tiene ninguna función importante en el cuerpo humano, provoca mucho daño luego de que se ingiere en la comida, en el agua o en el aire.
El plomo puede producir distintos efectos indeseados, tales como:
- Aumento de la presión sanguínea.
- Molestia de la biosíntesis de hemoglobina y posterior anemia.
- Espontáneo aborto.
- Daña los riñones.
- Provoca daño en el cerebro.
- Perturba el sistema nervioso.
- Produce disminución a los niños en sus habilidades de aprendizaje.
- Provoca disminución al hombre de su fertilidad porque daña el esperma.
- Provoca graves alteraciones en la equilibriocepción, la propiocepción, la electrocepción, la nocicepción, la ecolocalización y la magnetocepción de algunos animales.
- Perturba el comportamiento infantil como hipersensibilidad, agresión y comportamiento impulsivo.
- El plomo puede ingresar al feto por la placenta y producir daños serios al cerebro y el sistema nervioso.
- La creación de depósitos plúmbicos en el área de las encías que crean una línea de color azulado claro gris a la que se le llama la línea del plomo.
- En la naturaleza, el plomo puede encontrarse de forma natural en el medio ambiente. Sin embargo, las concentraciones mayores de este elemento resultan por las actividades humanas.

Vea también...