Configuración electrónica del Cobre

Dentro de la tabla corresponde al símbolo Cu, el cual posee el 29 como número atómico. Es el tercer metal de mayor uso a nivel mundial ocupando el primer y segundo lugar el hierro y el aluminio.
Para conocer la configuración electrónica del cobre se ha de realizar la regla de las diagonales, esta es:
- 1s
- 2s 2p
- 3s 3p 3d
- 4s 4p 4d 4f
- 5s 5p 5d 5f
- 6s 6p 6d 6f
- 7s 7p 7d 7f
Siguiendo esta regla lo que se hace es colocar la cantidad de electrones que puede contener un orbital, teniendo en cuenta el rango máximo que esta soporta, según esto se irá colocando el superíndice.
Por ejemplo:
- El orbital s se llena con 2 electrones por ello se coloca como s2.
- El orbital p se llena con 6 electrones.
- El d con 10 electrones
- El orbital f con 14 electrones.
Luego de tener en cuenta la regla de las diagonales y la capacidad máxima de electrón que puede albergar cada orbita, se ha de tomar el número atómico del cobre, que en este caso es 29 y se comienza a distribuir cada electrón, obteniéndose así la siguiente configuración electrónica:
1s2 2s2 2p6 3s2 3p6 4s2 3d9
Al sumar todos los superíndices debe de dar la cantidad total de electrones que en este caso es igual a su número atómico, o sea, debe de dar 29.
Configuración electrónica del cobre sin el uso de las reglas de las diagonales
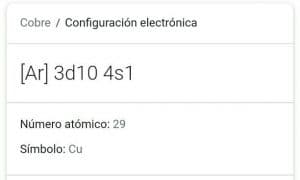
3d104s1 – Esto es lo que refleja el cambio de 3d104s1 que son los terminales de la configuración electrónica 1s2 2s2 2p6 3s2 3p6 4s2 3d9.
Este cambio se debe a que a las fuerzas de atracción entre los electrones y los protones del núcleo, se le adiciona la interferencia de las capas electrónicas internas, lo cual se genera cuando los niveles de energía se desvían del último electrón que se añadió al orbital, consiguiéndose así una configuración mucho más estable y diferente a la que se esperaba.

Vea también...