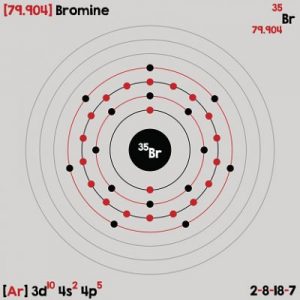
Configuración electrónica del Bromo
A temperatura ambiente, el bromo es un líquido de tonalidad roja, denso y volátil. Su reactividad es intermedia entre el yodo y el cloro. En estado líquido constituye un peligro para el tejido humano. Sus vapores causan irritación en la garganta y en los ojos.
En los humanos, el bromo es encontrado a nivel de trazas. Se considera como un elemento químico importante aunque no se tiene conocimiento exacto de las funciones que desempeña. Algunos de sus componentes se han usado para tratar la epilepsia y como sedantes.
Configuración Electrónica del Bromo
Para encontrar la configuración, esta se lee a través de una diagonal desde arriba hasta abajo. A esta técnica se le llama método de lluvia o principio de construcción. Se empieza a partir de los subniveles de energía menor hasta sumar la totalidad de cantidades de los electrones que tiene el elemento.
En pocas palabras, para llevar a cabo la configuración electrónica del bromo se tiene presente el diagrama de Moeller y el número atómico (Z) del elemento, en este caso es 35.
Configuración Electrónica Abreviada del Bromo
Es posible abreviar la configuración electrónica empleando los gases nobles argón, neón, radón y kriptón. Se siguen los siguientes pasos:
- Se hace una búsqueda del gas noble que le antecede al bromo.
- Se hace un cambio en los subniveles de energía en los que sus exponentes sumen la cantidad del número atómico del gas noble por el símbolo del bromo.
El gas noble que le antecede al bromo es el argón (Ar), su número atómico es 18. Esto significa que la configuración electrónica de Kernel o configuración abreviada de este elemento es [Ar] 3d¹⁰ 4s² 4p⁵
De esta forma, la configuración electrónica del bromo especifica que existen 4 niveles de energía junto a 7 electrones de valencia.
Características del Bromo
- El bromo se descubrió en 1826 y empezó a producirse en cantidades importantes en 1860.
- El bromo molecular se consigue partiendo de las salmueras, a través de la oxidación producida en el bromuro con cloro.
- Gran parte del bromo se localiza en el mar con apariencia de bromuro.
- Existen dos isótopos en la naturaleza: 79Br y 81Br. Ambos tienen una abundancia que ronda el 50%.
- El bromo elemental es sumamente tóxico y parte en trozos pequeños como inhalación y vía dérmica. Puede producir problemas de salud inmediatos y en dosis grandes causa la muerte. Es sumamente irritante para la garganta y los ojos, produce quemaduras dolorosas cuando entra en contacto con la piel. Un manejo inadecuado puede producir un riesgo serio para la salud.
Aplicaciones del Bromo
Las aplicaciones industriales y químicas del bromo son variadas y numerosas. Se destacan los compuestos organobromados los cuales se preparan con bromuro de hidrógeno también llamado ácido bromhídrico disuelto acuosamente o el bromo diatómico.
En la prueba del bromo se usa el agua de bromo con el propósito de detectar compuestos orgánicos que sean insaturados. Los bromuros trabajan de manera clínica como sedantes y el bromuro de plata se emplea como elemento básico en las placas de fotografía.

Vea también...