Configuración electrónica del Europio
Se descubrió en 1890 y se aisló por primera vez en el 1901. El nombre del elemento es dado por el continente de Europa. Este elemento es el que tiene mayor reactividad de todos los elementos pertenecientes a las tierras raras.
En el ambiente de trabajo, el europio resulta ser muy peligroso porque los gases y los vapores que este despide pueden ser absorbidos en el aire.
Esta en inhalación puede producir embolias pulmonares, mayormente en las exposiciones dadas a largo plazo. También puede provocar problemas graves en el hígado cuando el elemento es acumulado en el cuerpo.
Configuración Electrónica del Europio

La configuración electrónica perteneciente al europio se puede hacer de dos maneras: de forma simplificada o abreviada y de forma completa.
La versión abreviada es [Xe]6s24f7 mientras que la configuración electrónica completa de este elemento es 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p6 4f7 6s2.
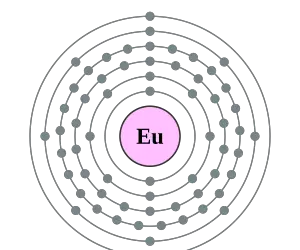
Al Europio poseer 63 electrones en total, su distribución se hace de la siguiente manera:
- La primera capa posee 2 electrones.
- La segunda capa alberga 8.
- En la tercera capa se ubican 18 electrones.
- En la cuarta existen 25.
- En la quinta capa hay 8 electrones.
- En la sexta y última capa únicamente existen 2 electrones.
Propiedades del Europio
El europio es un elemento que se ubica en el grupo de los lantánidos, a estos también se les conoce por el nombre de tierras raras porque tienen una presencia habitual a manera de óxidos. Los lantánidos y los actínidos son los elementos pertenecientes a la transición interna.
La forma natural en la que se encuentra el europio es en estado sólido. Este elemento químico tiene un aspecto plateado y blanco, forma parte del grupo de los lantánidos. Su número atómico es 63 y se representa por el símbolo Eu.
- El punto de ebullición de este elemento es de 1527,85 grados centígrados o grados Celsius, que es similar a 1800 grados Kelvin.
- El punto de fusión es de 826,85 grados centígrados o grados Celsius siendo igual a 1099 grados Kelvin.
- La masa atómica del europio se determina por la masa completa de protones y neutrones que se ubican en un único átomo que forma parte de este elemento. El europio se encuentra en el periodo 6 de la tabla periódica y su masa atómica es igual a 151,964 u.
Aplicaciones y Usos del Europio
El europio metálico no tiene aplicaciones comerciales, aunque anteriormente se ha empleado para la contaminación de algunas clases de plásticos con la finalidad de elaborar láseres. Este elemento es un adecuado absorbente de neutrones y se estudia con la finalidad de usarse en reactores nucleares.
El europio crea compuestos fluorescentes que se utilizan en dispositivos tales como lámparas fluorescentes, televisores a color y en cristales. Cada uno de sus compuestos químicos raros poseen propiedades comparables.
El oxido de europio, cuya nomenclatura es (Eu2O3), es muy utilizado como sustancia fluorescente para los aparatos de televisión. También para activar otros fosforescentes que se basan en el itrio.
La configuración del Europio y la Salud
Este elemento es uno de los tantos elementos químicos raros que se encuentra en lámparas fluorescentes, en cristales y en televisiones a color. Cada uno de los compuestos químicos raros que existen poseen las llamadas propiedades comparables.
Es muy raro que el europio se encuentre en la naturaleza porque se da en cantidades sumamente pequeñas. Normalmente este elemento es ubicado sólo en dos clases diferentes de minerales. La utilidad del europio continúa en aumento porque es útil para pulir cristales y crear catalizadores.
Este elemento constituye ser una peligrosidad en el ambiente laboral porque los gases y las humedades pueden inhalarse en el aire causando embolias pulmonares, mayormente cuando las exposiciones se producen a largo plazo. El europio puede afectar gravemente al hígado cuando este es acumulado en el organismo.
El Europio en el Medio Ambiente
El europio se vierte en el medioambiente en distintos lugares, mayormente por las industrias que producen petróleo. También puede ingresar al ambiente cuando se desechan los equipos domésticos. Este elemento tendrá una acumulación gradual en el agua de los suelos y en los suelos en general, trayendo como consecuencia un incremento de la concentración del europio en animales, humanos y en partículas.
En los animales acuáticos, el europio produce daños en las membranas celulares. Esto afecta negativamente las funciones de reproducción y del sistema nervioso.

Vea también...