¿Qué es la estructura atómica?
 Anteriormente, a la materia se le consideraba como algo de carácter continuo e invisible hasta que, en el siglo XVIII, se confirmó que era posible dividir lo que se consideraba indivisible mediante diversos experimentos, en partículas más pequeñas, que llamamos átomos.
Anteriormente, a la materia se le consideraba como algo de carácter continuo e invisible hasta que, en el siglo XVIII, se confirmó que era posible dividir lo que se consideraba indivisible mediante diversos experimentos, en partículas más pequeñas, que llamamos átomos.
En el año 1838, John Dalton sentó las bases de la teoría atómica en su libro Nuevo Sistema de Filosofía Química, al postular que la materia estaba compuesta por unidades elementales, que posteriormente denominó átomos, en esta teoría establecía lo siguiente:
- Los elementos, están constituidos por átomos.
- Los átomos de diferentes elementos presentan diferencias de masa y propiedades.
- Los átomos de un mismo elemento son iguales en cuanto a su masa y las propiedades que poseen.
- En las reacciones químicas, los átomos no se crean ni se destruyen, sino más bien se redistribuyen para la formación de nuevos compuestos.
La estructura atómica
Modelos atómicos
 Luego de haberse descubierto que los átomos se componían de partículas poseedoras de energía, tanto positiva como negativa, es decir, protones y electrones.
Luego de haberse descubierto que los átomos se componían de partículas poseedoras de energía, tanto positiva como negativa, es decir, protones y electrones.
Los científicos decidieron investigar y, a su vez, proponer diversos modelos que explicaran porque los átomos se constituían de la manera que hoy en día tenemos entendido, dando lugar a diversos modelos entre los cuales se encontraban:
El modelo de Thompson
Joseph J. Thompson propuso su modelo atómico en el año 1898, en el cual básicamente, suponía la existencia de una esfera de electricidad positiva (aun no se habían descubierto los protones como partículas indivisibles) que incluía electrones para neutralizar la electricidad positiva y para ello se valía de tantos electrones encajados en dicha esfera como fuese necesario.
Modelo de Rutherford
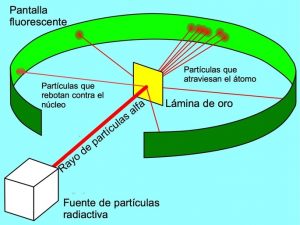
Ernest Rutherford fue un científico británico que en 1911 propuso un experimento consistente en bombear con partículas α una lámina de oro con una anchura de aproximadamente dos mil átomos para obtener más información de la estructura de los átomos observando mediante este experimento los choques de partículas que atravesaban dicha lámina sobre una pantalla situada detrás de ella.
A partir de esto, Rutherford elaboró un modelo (considerado el primer modelo que explicó la teoría del átomo) que se basaba en lo siguiente:
- La materia está prácticamente “hueca”; un gran número de partículas α la atravesaron directamente.
- La existencia de partículas neutras en el núcleo.
- Debido a las repulsiones electrostáticas que sufren, las partículas α rebotan al pasar cerca de cargas positivas; al espacio que ocupan estas cargas en el interior del átomo se le denomino núcleo. La existencia del núcleo fue confirmada tras el posterior descubrimiento de los protones y su agrupación en este.
- Los electrones deben girar alrededor del núcleo para no precipitarse sobre él y su giro compense la fuerza electrostática de atracción a fuerzas contrarias.
El núcleo y la corteza de los átomos
Fue James Chadwick quien en el 1932 completo la estructura atómica mediante el descubrimiento de los electrones. Observó que se desprendía cierta radiación al bombear átomos de berilio con partículas α y, al estudiarlas, comprobó que estaban formadas por partículas neutras, las cuales tenían una masa ligeramente mayor a la del protón.
¿De qué está formada la estructura atómica?
- Nucleones, un núcleo positivo, donde se encuentran los protones y los neutrones.
- Zona cortical o corteza, donde giran los electrones alrededor del núcleo.
¿Cómo se caracterizan los núcleos atómicos?
- El número atómico: representado por la letra “Z”. Indica el número de protones que se encuentran en el núcleo de un átomo.
- El número másico: representado por la letra “A”. Indica tanto el número de protones como de neutrones que se encuentran en el núcleo atómico.
Isótopos
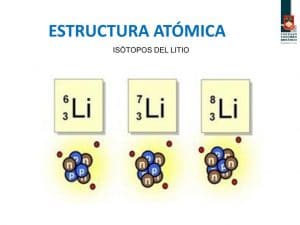 A los átomos que presentan un número diferente de neutrones y, por ello distinto número másico se les llama isótopos.
A los átomos que presentan un número diferente de neutrones y, por ello distinto número másico se les llama isótopos.
Thompson, experimentando con iones de gas de neón en el 1912, observó que en algunas ocasiones las masas de esos iones eran diferentes entre sí.
Aproximadamente, 8 años más tarde, en el 1920, su discípulo F.W. Aston mediante la utilización de un espectrógrafo de masas (aparato empleado para el análisis de átomos a través de la impresión de marcas distintas según su número de masa), confirmó que las masas no eran diferentes solo en los iones de neón, sino en muchos de los elementos.
Tipos de isótopos
- Naturales: se observan 280 isótopos, en los 90 elementos encontrados en la naturaleza.
- Artificiales: Hasta ahora se han observado más de 2000; son aquellos que se preparan en el laboratorio, ya sea, en la obtención de nuevos elementos o aumentando el contenido neutrónico de los átomos estables con el uso de partículas radioactivas.

También te puede interesar...