Características de la tabla periódica
 La tabla periódica de los elementos es el esquema donde se encuentra colocado el registro de los elementos químicos descubiertos e identificados hasta el momento, ordenados por sus propiedades químicas, su número atómico y por su configuración de electrones.
La tabla periódica de los elementos es el esquema donde se encuentra colocado el registro de los elementos químicos descubiertos e identificados hasta el momento, ordenados por sus propiedades químicas, su número atómico y por su configuración de electrones.
Características de la tabla periódica
Historia de la tabla periódica
 La clasificación de los elementos fue iniciada por Dmitri Mendeléyev en el 1869, desarrollada en ese momento con el objetivo de ilustrar los elementos conocidos exponiendolos de la manera más adecuada y sencilla posible, para mostrar sobre todo las tendencias periódicas de estos elementos y ordenarlos según las propiedades químicas que estos presentaban.
La clasificación de los elementos fue iniciada por Dmitri Mendeléyev en el 1869, desarrollada en ese momento con el objetivo de ilustrar los elementos conocidos exponiendolos de la manera más adecuada y sencilla posible, para mostrar sobre todo las tendencias periódicas de estos elementos y ordenarlos según las propiedades químicas que estos presentaban.
Más tarde por la aparición, el descubrimiento y la necesidad de clasificar los nuevos elementos, otros científicos modificaron la tabla de Mendeléyev incorporando en ella nuevos elementos; además se encargaron de proporcionarle una fácil distinción a cada elemento.
La estructura de la tabla periódica actual fue diseñada a partir de la versión de Mendeléyev por Alfred Werner.
Organización de la tabla periódica
La característica principal de la tabla periódica la encontramos en su estructura y organización. En este artículo, nos basaremos en la tabla periódica actual en la cual se encuentran clasificados todos los elementos conocidos hasta el día de hoy.
En la tabla periódica podemos conocer los 118 elementos presentes en la tierra, conocer su masa atómica, su peso y su valencia, esta se organiza en:
- Grupos.
- Periodos.
- Metales.
- No metales.
- Metales pesados.
- Metales ligeros.
- Gases inertes.
- Gases nobles.
- Tierras raras.
- Gases inertes.
- Sólidos.
- Líquidos.
- Sintéticos.
¿Cómo se organizan los elementos de la tabla periódica?
Los elementos de la tabla periódica, se encuentran ordenados en 18 columnas verticales conocidas como grupos o familias y 7 filas horizontales que denominamos periodos.
Su tipo de estructura
Dentro de la estructura de la tabla periódica encontramos la información contenida de cada elemento, esto es:
- Número atómico.
- Número de masa.
- Punto de fusión.
- Punto de ebullición.
- Número de isótopos.
- Densidad.
- Estado de oxidación, entre otros.
Organización en grupos de la tabla periódica
Columnas verticales encontradas en la tabla periódica. Enumerados de izquierda a derecha del 1 al 18, iniciando con los metales alcalinos y finalizando con los gases nobles.
La organización en estos grupos depende de la similitud de sus configuraciones electrónicas y el número de electrones en su última capa, es decir, su número de valencias.
De esta manera los elementos se dividen en:
- Grupo 1 (IA), metales alcalinos.
- Grupo 2 (IIA), metales alcalinotérreos.
- Grupo 3 (IIIB), familia del escandio, que comprenden las tierras raras y actínidos.
- Grupo 4 (IV B), familia del titanio.
- Grupo 5 (VB), encontramos la familia del vanadio, elemento químico cuyo número atómico es el 23.
- Grupo 6, encontramos la familia del cromo.
- Grupo 7, la familia del manganeso.
- Grupo 8, familia del hierro.
- Grupo 9, familia del cobalto.
- Grupo 10, encontramos la familia del níquel.
- Grupo 11, la familia del cobre.
- Grupo 12, familia del Zinc.
- Grupo 13, encontramos los térreos.
- Grupo 14, los carbonoideos.
- Grupo 15, los nitrogenoideos.
- Grupo 16, los anfígenos o colágenos.
- Grupo 17, halógenos.
- Grupo 18, los gases nobles.
Períodos de la tabla periódica
En la tabla periódica, los periodos se hallan determinados por el número de nivel enérgico de un átomo y cada nivel se divide en subniveles.
1s
2s 2p
3s 3p 3d
4s 4p 4d 4f
5s 5p 5d 5f
6s 6p 6d 6f
7s 7p 7d 7f
De esta manera, cada elemento daría forma a la tabla periódica y se colocarían según su configuración electrónica.
La tabla periódica cuenta con 7 períodos y los elementos pertenecientes a un mismo periodo presentan tendencias similares de electronegatividad, afinidad electrónica, ionización y radio atómico.
Bloques de la tabla periódica
Denominados según el orbital encontrado en su último electrón, clasificándose en S, P, D, F.
Bloque S
Comprende los elementos del grupo 1 y 2, esto es, los metales alcalinos y los alcalinotérreos.
Bloque P
Compuesto por los grupos del 13 al 18.
Bloque D
Comprende los grupos del 3 al 12.
Bloque F
Comprende al grupo de los lantánidos y actínidos.
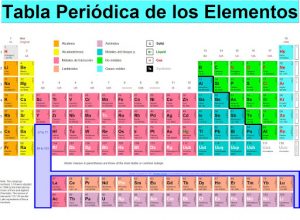
Colores de la tabla periódica
 La tabla periódica a menudo utilizan el color para resaltar otras características, ya sean físicas o químicas de los elementos, mayormente representando el grupo al que pertenecen.
La tabla periódica a menudo utilizan el color para resaltar otras características, ya sean físicas o químicas de los elementos, mayormente representando el grupo al que pertenecen.
En su parte superior las tablas contienen pequeños cuadritos de colores que representan el grupo al que pertenece el elemento.
Por ejemplo, si observamos esa parte nos daremos cuenta de que el cloro y el oxígeno se encuentran marcados con colores rojos debido a que son elementos gaseosos. Ustedes dirán pero ¿cómo así? ciertamente no se corresponden con el elemento, sin embargo, bajo ciertas condiciones de presión y temperatura estos elementos alcanzan un estado gaseoso.
Tanto el cloro como el oxígeno diatómico (poseen dos átomos) a partir de -340C y -1830C son gaseosos gracias a las moléculas que lo forman no al elemento en si.

También te puede interesar...