Diagrama de orbitales
Diagramas de orbitales moleculares
Es de carácter descriptivo con mira hacia el enlace covalente, donde según este enfoque, los electrones de valencia influyen en la estabilidad de la molécula.
El principio fundamental de esta teoría es que una cierta cantidad de orbitales atómicos se unen para la formación de un mismo número de orbitales moleculares.
Este diagrama fue introducido en 1928 por Robert S. Milliken; Pueden explicar la existencia de ciertas moléculas y la no existencia de otras. Este diagrama es fácilmente adaptable para moléculas diatómicas simples, como es el caso de la dioxina y el monóxido de carbono; su uso se vuelve complejo al hablar sobre las moléculas poliatómicas que, en ocasiones, pueden ser relativamente simples como es el caso del metano.
En el diagrama de orbitales, ¿Qué representa cada cuadro?
Según el modelo cuántico, 1 orbital será el equivalente a una rayita horizontal y cada flecha representará un electrón. Puede haber un máximo de dos electrones en cada orbital, como sus espines son uno positivo y otro negativo, las flechas serán colocadas una hacia arriba y otra hacia abajo.
Si vamos a la teoría electromagnética, veremos que cuando un electrón genera un campo electromagnético al girar una carga, este movimiento (giro) es el que hace posible que el electrón se comporte como un imán.
Los dos únicos posibles giros del electrón son uno a favor y otro en contra de las manecillas del reloj; por ello, es preciso añadir un número cuántico al tomar en cuenta su espín, es decir, que el espín del electrón tomará valores de +1/2 o -1/2, en una forma simple de decirlo.
Distribución de orbitales
Para la representación de la distribución de electrones en los orbitales de los diferentes niveles, la manera más útil y hasta ahora empleada es la figurada simbólicamente por la notación nlx , donde:
- N: representa el nivel principal (en forma numérica).
- I: representa el subnivel (simbolizado por las letras: S, P, D, F).
- X: número total de electrones presentados en este subnivel.
¿Cuáles son las reglas para el llenado de los orbitales?
Existen 3 reglas fundamentales:
- Principio de exclusión de Pauli: afirma que, en ningún sistema orbital (átomo), dos electrones pueden tener iguales sus cuatro números cuánticos.
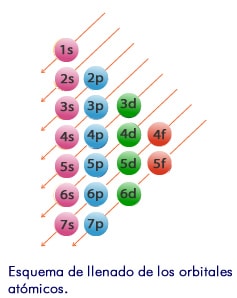
- El principio de Aufbau: establece que los orbitales llenan se llenan de manera progresiva, es decir, según sus energías relativas, iniciando por aquellos de menor energía.
- La regla de Hund o de máxima multiplicidad: dice que los espines de los electrones permanecen desapareados, al llenar los orbitales de energía equivalente, es decir, si los orbitales son llenados de manera que queden iguales, el espín resultante será el máximo.
Tipos de orbitales
Existen 4 tipos de orbitales que son:
- S
- P
- D
- F
Recuerden que los orbitales son conocidos como subniveles de energía y pueden contener diferentes números de electrones:
- S=2 electrones.
- P= 6 electrones.
- D= 10 electrones.
- F= 14 electrones.
¿Cómo realizar un diagrama de orbitales?
Una vez conocida la definición, la organización y las reglas, es hora de practicar realizando un diagrama de orbitales para el Oxigeno (O), es bastante fácil, así que aquí te dejo los pasos:
Una vez seleccionado el elemento, en este caso Oxigeno, lo primero que debes encontrar es su numero atómico (nos dirá el numero de electrones que posee y posteriormente escribiremos en el diagrama de orbitales). Buscamos en nuestra tabla periódica y encontramos que su número atómico es igual a 8 (Z=8), ese será el número de electrones de nuestro diagrama.
- Realizamos nuestra configuración electrónica, según el principio de construcción, empezando por las subcapas de menor energía, trazamos las diagonales; recuerden que en los casos donde el número atómico es bajo no es necesario colocar todos los niveles.
En este paso les será necesario recordar la cantidad de espacio que ocupa cada subnivel; los exponentes de los orbitales representan el número de electrones, procedemos:
1s2 2s2 2p4
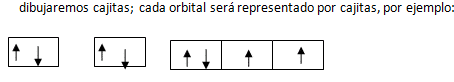
Luego de realizar nuestra configuración, procedemos a dibujar nuestro diagrama, para ello dibujaremos pequeñas cajas; cada orbital será representado por cajas, por ejemplo:
Recuerden que por el principio de exclusión de Pauli, los electrones no pueden acomodarse con el mismo espín por ello se coloca una flechita hacia arriba y otra en sentido contrario. Una vez llegado hasta aquí, tengo para decirte que has completado tu diagrama de orbitales.

 Una vez seleccionado el elemento, en este caso
Una vez seleccionado el elemento, en este caso