| # Atómico | Elemento | Símbolo | Configuración Electrónica |
|---|---|---|---|
| 1 | Hidrogeno | H | 1s1 |
| 2 | Helio | He | 1s2 |
| 3 | Litio | Li | [He] 2s1 |
| 4 | Berilio | Be | [He] 2s2 |
| 5 | Boro | B | [He] 2s22p1 |
| 6 | Carbono | C | [He] 2s22p2 |
| 7 | Nitrogeno | N | [He] 2s22p3 |
| 8 | Oxigeno | O | [He] 2s22p4 |
| 9 | Flúor | F | [He] 2s22p5 |
| 10 | Neon | Ne | [He] 2s22p6 |
| 11 | Sodio | Na | [Ne] 3s1 |
| 12 | Magnesio | Mg | [Ne] 3s2 |
| 13 | Aluminio | Al | [Ne] 3s23p1 |
| 14 | Silicio | Si | [Ne] 3s23p2 |
| 15 | Fosforo | P | [Ne] 3s23p3 |
| 16 | Azufre | S | [Ne] 3s23p4 |
| 17 | Cloro | Cl | [Ne] 3s23p5 |
| 18 | Argón | Ar | [Ne] 3s23p6 |
| 19 | Potasio | K | [Ar] 4s1 |
| 20 | Calcio | Ca | [Ar] 4s2 |
| 21 | Escandio | Sc | [Ar] 3d14s2 |
| 22 | Titanio | Ti | [Ar] 3d24s2 |
| 23 | Vanadio | V | [Ar] 3d34s2 |
| 24 | Cromo | Cr | [Ar] 3d54s1 |
| 25 | Manganeso | Mn | [Ar] 3d54s2 |
| 26 | Hierro | Fe | [Ar] 3d64s2 |
| 27 | Cobalto | Co | [Ar] 3d74s2 |
| 28 | Niquel | Ni | [Ar] 3d84s2 |
| 29 | Cobre | Cu | [Ar] 3d104s1 |
| 30 | Zinc | Zn | [Ar] 3d104s2 |
| 31 | Galio | Ga | [Ar] 3d104s24p1 |
| 32 | Germanio | Ge | [Ar] 3d104s24p2 |
| 33 | Arsénico | As | [Ar] 3d104s24p3 |
| 34 | Selenio | Se | [Ar] 3d104s24p4 |
| 35 | Bromo | Br | [Ar] 3d104s24p5 |
| 36 | Kriptón | Kr | [Ar] 3d104s24p6 |
| 37 | Rubidio | Rb | [Kr] 5s2 |
| 38 | Estroncio | Sr | [Kr] 5s2 |
| 39 | Itrio | Y | [Kr] 4d25s2 |
| 40 | Circonio | Zr | [Kr] 4d45s1 |
| 41 | Niobio | Nb | [Kr] 4d55s1 |
| 42 | Molibdeno | Mo | [Kr] 4d55s2 |
| 43 | Tecnecio | Tc | [Kr] 4d55s2 |
| 44 | Rutenio | Ru | [Kr] 4d75s1 |
| 45 | Rodio | Rh | [Kr] 4d85s1 |
| 46 | Paladio | Pd | [Kr] 4d10 |
| 47 | Plata | Ag | [Kr] 4d105s1 |
| 48 | Cadmio | Cd | [Kr] 4d105s2 |
| 49 | Indio | In | [Kr] 4d105s25p1 |
| 50 | Estano | Sn | [Kr] 4d105s25p2 |
| 51 | Radio | Sb | [Kr] 4d105s25p3 |
| 52 | Telurio | Te | [Kr] 4d105s25p4 |
| 53 | Yodo | I | [Kr] 4d105s25p5 |
| 54 | Xenón | Xe | [Kr] 4d105s25p6 |
| 55 | Cesio | Cs | [Xe] 6s1 |
| 56 | Bario | Ba | [Xe] 6s2 |
| 57 | Lantano | La | [Xe] 5d16s2 |
| 58 | Cerio | Ce | [Xe] 4f5d6s2 |
| 59 | Praseodimio | Pr | [Xe] 4f36s2 |
| 60 | Neodimio | Nd | [Xe] 4f46s2 |
| 61 | Prometio | Pm | [Xe] 4f56s2 |
| 62 | Samario | Sm | [Xe] 4f66s2 |
| 63 | Europio | Eu | [Xe] 4f76s2 |
| 64 | Gadolinio | Gd | [Xe] 4f75d16s2 |
| 65 | Terbio | Tb | [Xe] 4f96s2 |
| 66 | Disprosio | Dy | [Xe] 4f106s2 |
| 67 | Holmio | Ho | [Xe] 4f116s2 |
| 68 | Erbio | Er | [Xe] 4f126s2 |
| 69 | Tulio | Tm | [Xe] 4f136s2 |
| 70 | Iterbio | Yb | [Xe] 4f146s2 |
| 71 | Lutecio | Lu | [Xe] 4f145d16s2 |
| 72 | Hafnio | Hf | [Xe] 4f145d26s2 |
| 73 | Tántalo | Ta | [Xe] 4f145d36s2 |
| 74 | Wolframio | W | [Xe] 4f145d46s2 |
| 75 | Renio | Re | [Xe] 4f145d56s2 |
| 76 | Osmio | Os | [Xe] 4f145d66s2 |
| 77 | Iridio | Ir | [Xe] 4f145d76s2 |
| 78 | Platino | Pt | [Xe] 4f145d96s1 |
| 79 | Oro | Au | [Xe] 4f145d106s1 |
| 80 | Mercurio | Hg | [Xe] 4f145d106s2 |
| 81 | Talio | Tl | [Xe] 4f145d106s26p1 |
| 82 | Plomo | Pb | [Xe] 4f145d106s26p2 |
| 83 | Bismuto | Bi | [Xe] 4f145d106s26p3 |
| 84 | Polonio | Po | [Xe] 4f145d106s26p4 |
| 85 | Ástato | At | [Xe] 4f145d106s26p5 |
| 86 | Radón | Rn | [Xe] 4f145d106s26p6 |
| 87 | Francio | Fr | [Rn] 7s1 |
| 88 | Radio | Ra | [Rn] 7s2 |
| 89 | Actinio | Ac | [Rn] 6d17s2 |
| 90 | Torio | Th | [Rn] 6d27s2 |
| 91 | Protactinio | Pa | [Rn] 5f26d17s2 |
| 92 | Uranio | U | [Rn] 5f36d17s2 |
| 93 | Neptunio | Np | [Rn] 5f46d17s2 |
| 94 | Plutonio | Pu | [Rn] 5f67s2 |
| 95 | Americio | Am | [Rn] 5f77s2 |
| 96 | Curio | Cm | [Rn] 5f76d17s2 |
| 97 | Berkelio | Bk | [Rn] 5f97s2 |
| 98 | Californio | Cf | [Rn] 5f107s2 |
| 99 | Einstenio | Es | [Rn] 5f117s2 |
| 100 | Fermio | Fm | [Rn] 5f127s2 |
| 101 | Mendelevio | Md | [Rn] 5f137s2 |
| 102 | Nobelio | No | [Rn] 5f147s2 |
| 103 | Lawrencio | Lr | [Rn] 5f147s27p |
| 104 | Rutherfordio | Rf | [Rn] 5f146d27s2 |
| 105 | Dubnio | Db | [Rn] 5f146d37s2 |
| 106 | Seaborgio | Sg | [Rn] 5f146d47s2 |
| 107 | Bohrio | Bh | [Rn] 5f146d57s2 |
| 108 | Hasio | Hs | [Rn] 5f146d67s2 |
| 109 | Meitnerio | Mt | [Rn] 5f146d77s2 |
| 110 | Darmstatio | Ds | [Rn] 5f146d97s1 |
| 111 | Copérnicio | Rg | [Rn] 5f146d107s1 |
| 112 | Roentgenio | Cn | [Rn] 5f146d107s2 |
| 113 | Nihonio | Nh | [Rn] 5f146d107s27p1 |
| 114 | Flerovio | Fl | [Rn] 5f146d107s27p2 |
| 115 | Moscovio | Mc | [Rn] 5f146d107s27p3 |
| 116 | Livermorio | Lv | [Rn] 5f146d107s27p4 |
| 117 | Teneso | Ts | [Rn] 5f146d107s27p5 |
| 118 | Oganesón | Og | [Rn] 5f146d107s27p6 |
La Configuración Electrónica

Para calcular la distribución de los electrones en los distintos niveles de energía, la configuración electrónica lo que hace es tomar los números cuánticos como referencia o simplemente lo utiliza para la distribución. Estos números permiten describir los niveles de energía de los electrones o de un solo electrón, además describen la forma de los orbitales que percibe en la distribución de los electrones dentro del espacio.
¡Las 15 elementos más consultados!
Tabla de configuración de los elementos

A través de la configuración electrónica se llega a establecer las propiedades de combinación desde un punto químico de los átomos, gracias a esta es que se conoce el lugar que le corresponde dentro de la tabla periódica. Esta configuración indica el orden de cada electrón en los diferentes niveles de energía, o sea, en las órbitas, o simplemente muestran la distribución de estos en torno al núcleo del átomo.
¿Por qué es importante la configuración electrónica?

Mientras más lejos esté el electrón girando en torno al núcleo más grande será este nivel de energía. Cuando los electrones que se encuentran en el mismo nivel de energía, este nivel toma el nombre de orbitales de energía. Puedes consultar la configuración de electrones de todos los elementos utilizando la tabla que aparece mas arriba de este texto educativo.
La configuración electrónica de los elementos también utiliza el número atómico del elemento el cual se consigue a través de la tabla periódica. Es necesario conocer que es un electrón, para poder estudiar detalladamente este valioso tema.
Esta identificación se logra debido a los cuatro números cuánticos que posee cada electrón, estos son:
- Número cuántico magnético: muestra la orientación del orbital en que está el electrón.
- Número cuántico principal: se trata del nivel de energía en la cual se halla el electrón.
- Número cuántico de giro o spin: se refiere al giro que tiene el electrón.
- Número cuántico azimutal o secundario: se trata del orbital en la cual está el electrón.
Objetivos de la configuración electrónica.
La principal finalidad de la configuración electrónica es dejar bien en claro el orden y la distribución energética de los átomos, en especial la distribución de cada nivel y subnivel de energía.
Tipos de configuración electrónica.
- Configuración estándar.
Esta configuración electrónica se consigue a través del cuadro de las diagonales, aquí los orbitales se llenan según van apareciendo y siguiendo siempre las diagonales del cuadro, partiendo siempre por el 1s.
- Configuración desarrollada. A través de esta configuración se representa cada uno de los electrones de un átomo usando flechas para así representar el spin de cada uno. En este caso el llenado se hace tomando en consideración la regla de máxima multiplicidad de Hund y el principio de exclusión de Pauli.
- Configuración condensada. Todos los niveles que llegan a mostrarse llenos en la configuración estándar se representan con un gas noble, donde hay una coincidencia entre el número atómico del gas y el número de electrones que llenaron el nivel final. Estos gases nobles son: He, Ar, Ne, Kr, Rn y Xe.
- Configuración semi-desarrollada. Se trata de una mezcla entra la configuración desarrollada y la configuración condensada. En esta únicamente se llegan a representar los electrones del último nivel de energía.
Puntos clave para escribir la configuración electrónica de un átomo.
- Se debe conocer el número de electrones que posee el átomo, para ello solo hay que conocer su número atómico ya que este es igual al número de electrones.
- Colocar los electrones en cada nivel de energía, iniciando con el más cercano.
- Respetar la capacidad máxima que posee cada nivel.
Pasos para obtener la configuración electrónica de un elemento

En este caso el número atómico dentro de la tabla periódica siempre se muestra en la zona superior derecha, por ejemplo, en el caso del hidrógeno será el número 1 que se observa en la parte superior de esta casilla, mientras que su peso atómico o número másico, es el que se encierra en la parte superior pero a mano izquierda.
Usando este número atómico es que se determinará su configuración a través de la utilización de los números cuánticos y de la respectiva distribución de electrones en la órbita
Estos son algunos ejemplos de configuración de elementos.
- Hidrógeno, su número atómico es 1, o sea Z=1, entonces, Z=1:1s1 .
- Potasio, su número atómico es 19, entonces, Z=19: 1s22s22p63s23p64s23d104p1.
Distribución electrónica.
Corresponde a la distribución de cada uno de los electrones en los orbitales y subniveles de un átomo. Aquí la configuración electrónica de estos elementos se rige a través del diagrama de Moeller.
Para poder determinar la distribución electrónica de cada elemento solo se ha de escribir las notaciones de manera diagonal partiendo desde arriba hacia abajo y de derecha a izquierda.
Clasificación de los elementos acorde a la configuración electrónica.
Todos los elementos químicos se llegan a clasificar en cuatro grupos, estos son:
- Gases nobles. Tienen completa su órbita electrónica con ocho electrones, sin incluir el He, el cual posee dos electrones.
- Elementos de transición. Poseen sus dos últimas órbitas incompletas.
- Elementos de transición interna. Estos poseen sus tres últimas órbitas incompletas.
- Elemento representativo. Estos poseen una órbita externa incompleta.
Uso de los elementos y compuestos
Gracias a la configuración electrónica de los elementos se puede conoce la cantidad de electrones que poseen los átomo en sus orbitas lo cual llega a ser de gran utilidad a la hora de construir enlaces iónicos, covalentes y tener conocimiento sobre los electrones de valencia, estos últimos corresponde al número de electrones que posee el átomo de cierto elemento en su última órbita o capa.




























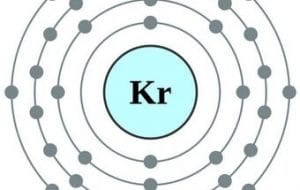









 Esta configuración electrónica se consigue a través del cuadro de las diagonales, aquí los orbitales se llenan según van apareciendo y siguiendo siempre las diagonales del cuadro, partiendo siempre por el 1s.
Esta configuración electrónica se consigue a través del cuadro de las diagonales, aquí los orbitales se llenan según van apareciendo y siguiendo siempre las diagonales del cuadro, partiendo siempre por el 1s.