
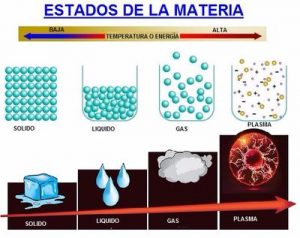
Durante mucho tiempo se consideró que solo existían 3 estados de la materia (sólido, líquido y gaseoso). Sin embargo, el avance científico y las nuevas tecnologías ayudaron al descubrimiento de nuevos estados.
Los estados de la materia
Estado sólido
Propiedad principal: materia fija.
Características
- Los sólidos, se caracterizan por la rigidez y la regularidad de sus estructuras.
- Mantienen su forma y volumen.
- La fuerza de atracción entre las moléculas individuales es muy elevada, mayor a la energía responsable de la separación de dichas partículas.
- Limitan su vibración al espacio que ocupan.
- Debido a que no es posible reducir su volumen presionandolos, no se pueden comprimir.
- Aumentan de volumen cuando se calientan (dilatación).
- Disminuyen su volumen cuando se enfrían (contraen).
- Resistencia a la fragmentación.
- Fluido muy bajo o incluso nulo.
Tipos de sólidos
De acuerdo a su forma, los sólidos se pueden clasificar en dos tipos:
- Sólidos amorfos o vítreos, aquellos que presentan una forma variada e irregular, debido a que sus partículas no se hayan unidas de forma ordenada.
- Cristalinos, Presentan una forma regular; como formas geométricas, sus partículas se ordenan en celdas.
Algunos ejemplos notables de los sólidos son:
- Los metales.
- La madera.
- Los huesos.
- Las piedras.
- Los minerales.
Estado líquido
Puede ser considerado como un estado intermedio entre el estado sólido y el gaseoso, debido a que sus partículas presentan una cohesión mínima al encontrarse lo bastante cerca, permitir la fluidez y el cambio de forma al mantenerse dispersas.
Características físicas
Forma
Los líquidos no tienen forma definida, generalmente, adoptan la forma del recipiente en que se encuentren contenidos.
Viscosidad
Las fuerzas internas de las partículas de los líquidos presentan un acción que atrasa su deformación al dejarlo caer o verterlo en algún recipiente, por lo tanto, la viscosidad que presentan en sí es su resistencia a fluir.
Fluidez
Las partículas líquidas carecen de forma, por tanto, pueden escurrirse, deslizarse y movilizarse, permitiéndoles abandonar un recipiente y ser cambiado a otro. Si no se encuentran contenidos, fluyen con mucha facilidad por ello, al igual que a los gases, se les denomina fluidos.
Densidad
Gracias a la densidad de los líquidos, sus partículas se mantienen unidas; su margen de densidad es menor que el de los sólidos.
Adherencia
Pueden pegarse a las superficies.
Ejemplos:
Algunos ejemplos presentables de la materia en estado líquido son:
Estado gaseoso
En este caso, las fuerzas de atracción son casi inexistentes, sus partículas se encuentran dispersas, se mueven rápidamente y en cualquier dirección; en ocasiones, pueden ser incoloros y no presentan forma ni volumen fijos.
Se caracterizan por la poca unidad de sus partículas entre sí, presentar una enorme capacidad para ser comprimidos y poseer una fuerza de atracción leve que se relaciona con la unidad de sus partículas.
¿Cómo se transforma la materia al estado gaseoso?
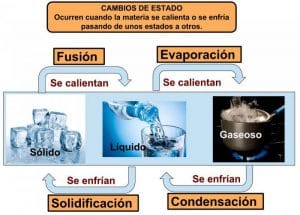
- Evaporación (de líquido a gas), este proceso lo observamos a diario cuando colocamos el agua para hervir los víveres, cuando supera el punto de ebullición, el agua llega a hervir a los 100 grados y se convierte en gas (vapor).
- Condensación (de gas a líquido), es el proceso contrario a la evaporación. Este, tiene que ver con la sustracción de calor o energía calórica en un gas. Un ejemplo de este es el ciclo del agua (la lluvia).
- Sublimación, es el proceso consistente en el cambio de estado de sólido a gaseoso, obviando el estado líquido.
- Sublimación inversa, es el proceso de pase directo entre estado gaseoso y sólido.
Estado plasmático
Los plasmas son conductores de electricidad, un gas ionizado de alta temperatura cuyas partículas internas poseen cargas; están formados por cationes (átomos con carga positiva) y electrones libres (carga negativa).
Como estado, vendría siendo la forma en que se presentan los gases encontrados en lo interno de los tubos fosforescentes, las luces de neón; se dice que el 99% de la materia que podemos observar es plasma.
Cualquier átomo que pierde un electrón, en una baja atmósfera terrestre, está ionizado. Pero según la ley de gases ideales, cuanto más caliente se encuentra el gas más rápido se mueven sus moléculas.
Tipos de plasma
- Plasmas fríos, los electrones se aceleran hasta alcanzar los 50000C de temperatura y sus átomos están en temperatura ambiente.
- Plasmas calientes, los átomos se ionizan entre sí por los choques que producen haciendo que el gas se caliente.
Otros estados de la materia
Podemos encontrar:
- El condensado de Bose-Einstein.
- El condensado de Fermi.
- Supersolido.
- Super fluido.
- Materia fotónica.
- Líquido de spin cuántico.
- Materia de quarks.
- Materia degenerada.
- Materia simétrica (fuerte y débil).
- Superfluido polaritón.

