De ese mismo modo están los átomos, la unidad más básica de la materia que a su vez se forma de neutrones protones y neutrones. Cuando dos o más átomos interactúan entre sí y empiezan a transmitirse electrones crean un puente que los mantiene unidos, a ese puente se le llama enlace químico.
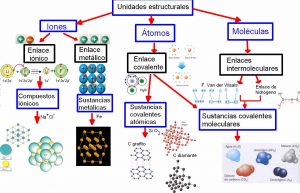
Los enlaces químicos se pueden dividir en dos categorías:
- Enlaces intramoleculares.
- Enlaces intermoleculares.
Tipos de enlaces químicos
Enlaces intramoleculares
Enlace iónico
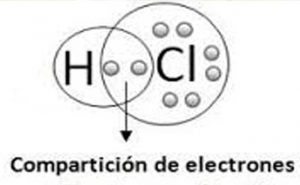
Un enlace iónico, también denominado electrovalente, se forma de la unión de un ion con mucha electronegatividad y otro con poca, por ejemplo, la unión de un metal y un no metal.
En resumen, es debido a interacciones de carácter electrostático entre los iones con diferentes cargas, formándose por la transferencia de uno o más electrones de un átomo a otro.
La mayor probabilidad de enlace iónico se da con los metales y no metales, en los cuales la transferencia de electrones se da de forma permanente de un átomo metálico a otro que no lo es. Durante la transferencia se produce una molécula contenedora de carga, ya sea en forma de catión (es decir carga positiva) o anión (carga negativa).
El tipo de atracción que se da en este tipo de enlace da lugar a compuestos estables mediante la unión electrostática, cuyas propiedades resultan en buena conducción eléctrica, alta solubilidad en agua, altos puntos de fusión y cristalización al disminuir la temperatura.
Enlace covalente
Son aquellos que unen dos átomos y ambos intercambian o comparten electrones. Se caracterizan porque sus átomos de unión poseen cargas electronegativas semejantes u idénticas. De forma simple, es el enlace donde no se pierde o gana en cantidad de electrones mediante la unión de sus átomos.
Por lo general, son más estables que los enlaces iónicos y forman parte de la naturaleza orgánica. Poseen un punto de fusión bajo y no conducen electricidad. Dependiendo de la cantidad de electrones compartidos puede ser de tres tipos:
- Simple (A-A), sus enlaces están formados por un par de electrones en su última capa, por ejemplo, HH, Hcl.
- Doble (A=A), sus átomos de enlace aportan dos electrones cada uno.
- Triple, sus tomos aportan 3 pares, es decir 6 electrones.
También podemos encontrar:
Enlace Dativo, aquellos en los que uno de los átomos de enlace permanece de forma inactiva a la hora de compartir electrones y el otro en cambio, aporta dos. Generando una asimetría en el balance de los electrones, por lo tanto, el átomo que aporta reorganiza su configuración para acomodarlo.
Enlaces metálicos
Este tipo de enlace solo se da entre los átomos metálicos de un mismo elemento. Constituyen estructuras fuertes y sólidas; adquieren una forma cristalina.
Enlace intermolecular
Como su nombre lo indica, son aquellos responsables de la unión entre sus moléculas. Se refiere a las interacciones realizadas entre las moléculas según la naturaleza de esta. Dentro de estos podemos encontrar:
- Enlace o puente de hidrógeno.
- Fuerzas de van der Waals.
Enlace o puente de hidrógeno
El puente de hidrógeno, solo se da entre átomos de hidrógenos con átomos de oxígeno, flúor, cloro y nitrógeno; en las sustancias que lo contienen, es el responsable de los puntos altos de fusión y ebullición.
Fuerzas de van der Waals
Es un tipo de unión que actúa en función de la atracción o repulsión de las moléculas.
Son fuerzas eléctricamente neutras, tanto polares como no polares, cuya fuerza de atracción es débil. Engloba de forma colectiva las fuerzas de atracción entre moléculas.
Incluyen:
Fuerzas dipolo-dipolo.
Los átomos están formados de distinta electronegatividad. Una molécula es un dipolo cuando existe una distribución asimétrica entre los electrones. En la molécula, se crean dos polos o regiones, una con carga parcial positiva y otro con carga parcial negativa, entonces, la en la fuerza dipolo dipolo se produce cuando dos moléculas se aproximan, dándose una interacción entre el polo positivo de una molécula y el polo negativo de la otra.
Fuerzas dipolo-dipolo inducido.
Son las fuerzas dadas entre una molécula polar y otra apolar.
Fuerzas dipolo instantáneo-dipolo inducido.
También denominadas fuerzas de London. Son fuerzas de atracción ocurridos de forma transitoria entre los dipolos.

