Enlaces iónicos, covalentes y metálicos
Enlaces iónicos, covalentes y metálicos. Los enlaces químicos son las fuerzas que mantienen unidos a los átomos para formar compuestos químicos. Estos enlaces son el resultado de la interacción entre los electrones de los átomos, ya sea mediante la transferencia de electrones, el intercambio de electrones o el compartimiento de electrones entre átomos. Los principales tipos de enlaces químicos son los enlaces iónicos, covalentes y metálicos. En este artículo, exploraremos en detalle cada uno de estos tipos de enlaces, así como sus propiedades, características, ejemplos y aplicaciones en el mundo real.
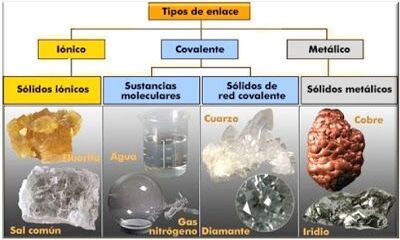
¿Qué son los enlaces iónicos?
Los enlaces iónicos son el resultado de la atracción electrostática entre iones de carga opuesta. Estos enlaces se forman cuando uno o más electrones son transferidos de un átomo a otro, creando iones cargados positiva y negativamente. El átomo que pierde electrones se convierte en un ion positivo (catión), mientras que el átomo que gana electrones se convierte en un ion negativo (anión). La fuerza de atracción electrostática entre estos iones mantiene unidos a los átomos en una estructura cristalina.
¿Qué son los enlaces covalentes?
Los enlaces covalentes se forman cuando dos átomos comparten uno o más pares de electrones entre sí. En este tipo de enlace, los electrones son compartidos de manera equitativa entre los átomos, lo que crea una atracción electrostática que mantiene unidos a los átomos en una molécula. Los enlaces covalentes pueden ser simples, dobles o triples, dependiendo del número de pares de electrones compartidos entre los átomos.
¿Qué son los enlaces metálicos?
Los enlaces metálicos son característicos de los metales y se forman cuando los electrones de valencia de varios átomos metálicos se deslocalizan y se mueven libremente a través de la estructura cristalina. Esta "nube" de electrones libres crea una fuerza de atracción electrostática que mantiene unidos a los átomos en una red tridimensional. Los enlaces metálicos son responsables de muchas de las propiedades características de los metales, como la conductividad eléctrica y térmica, la maleabilidad y la ductilidad.
Propiedades y características de los enlaces iónicos
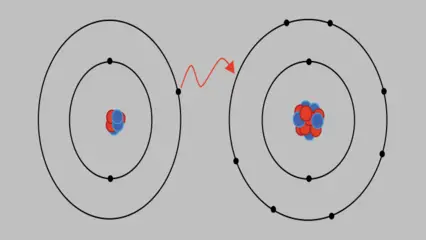
Los enlaces iónicos tienen varias propiedades y características distintivas:
- Solubilidad en agua: Los compuestos iónicos tienden a disolverse fácilmente en agua debido a la atracción entre los iones y las moléculas de agua, que son polares.
- Conductividad eléctrica: En estado fundido o disuelto en agua, los compuestos iónicos pueden conducir electricidad debido a la movilidad de los iones libres.
- Puntos de fusión y ebullición elevados: Los compuestos iónicos tienen altos puntos de fusión y ebullición debido a la fuerte atracción electrostática entre los iones.
- Estructura cristalina: Los compuestos iónicos suelen formar estructuras cristalinas ordenadas en estado sólido, donde los iones positivos y negativos se alternan regularmente.
Propiedades y Características de los Enlaces Covalentes
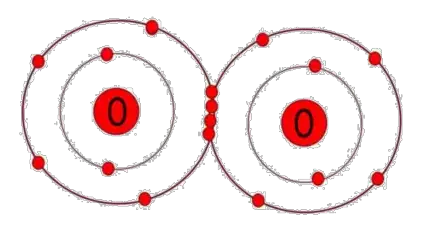
Los enlaces covalentes también presentan varias propiedades y características únicas:
- Solubilidad en solventes no polares: Los compuestos covalentes tienden a ser solubles en solventes no polares debido a la falta de cargas eléctricas.
- Bajos puntos de fusión y ebullición: Los compuestos covalentes generalmente tienen puntos de fusión y ebullición más bajos en comparación con los compuestos iónicos, ya que las fuerzas intermoleculares son más débiles que las fuerzas iónicas.
- Conductividad eléctrica baja: Los compuestos covalentes no conducen electricidad en estado sólido o líquido, ya que los electrones están firmemente unidos a los átomos y no están libres para moverse.
- Variedad de formas y estructuras: Los compuestos covalentes pueden adoptar una amplia variedad de formas y estructuras moleculares, incluyendo moléculas lineales, planas y tridimensionales.
Propiedades y características de los enlaces metálicos
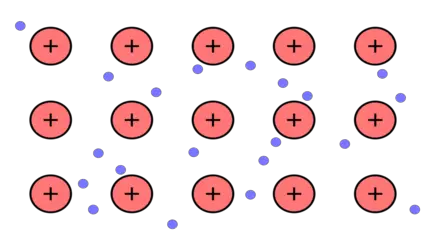
Los enlaces metálicos exhiben las siguientes propiedades y características:
- Conductividad Eléctrica y Térmica: Los metales son buenos conductores de electricidad y calor debido a la presencia de electrones libres que pueden moverse a través de la estructura metálica.
- Maleabilidad y Ductilidad: Los metales son maleables, lo que significa que pueden ser deformados bajo presión sin romperse, y son dúctiles, lo que significa que pueden ser estirados en alambres delgados sin romperse.
- Brillo Metálico: Los metales tienen un brillo característico debido a la capacidad de los electrones libres para absorber y reemitir energía en forma de luz visible.
- Estructura Cristalina Ordenada: Los metales suelen formar estructuras cristalinas ordenadas en estado sólido, donde los átomos están dispuestos en una red tridimensional con electrones libres móviles.
Ejemplos de enlaces iónicos
Algunos ejemplos comunes de compuestos con enlaces iónicos incluyen:
- Cloruro de Sodio (NaCl): Formado por la atracción entre iones de sodio (Na+) y cloruro (Cl-).
- Sulfato de Calcio (CaSO4): Compuesto por iones de calcio (Ca2+) y sulfato (SO42-).
- Nitrato de Amonio (NH4NO3): Contiene iones de amonio (NH4+) y nitrato (NO3-).
Ejemplos de enlaces covalentes
Algunos ejemplos de compuestos con enlaces covalentes son:
- Agua (H2O): Formada por la compartición de pares de electrones entre átomos de hidrógeno y oxígeno.
- Dióxido de Carbono (CO2): Contiene enlaces covalentes dobles entre átomos de carbono y oxígeno.
- Metano (CH4): Formado por enlaces covalentes simples entre átomos de carbono e hidrógeno.
Ejemplos de enlaces metálicos
Algunos ejemplos de metales que forman enlaces metálicos son:
- Hierro (Fe): Presenta enlaces metálicos en su estructura cristalina, lo que le confiere sus propiedades características.
- Cobre (Cu): Los átomos de cobre están unidos por enlaces metálicos que permiten la conducción de electricidad.
- Aluminio (Al): Forma una red tridimensional de átomos de aluminio con electrones libres que pueden moverse a través de la estructura.
Aplicaciones y usos de los diferentes tipos de enlaces
Los diferentes tipos de enlaces tienen una variedad de aplicaciones en la vida cotidiana, la industria y la investigación científica:
- Enlaces iónicos:
- Los compuestos iónicos, como el cloruro de sodio, se utilizan en la industria química para la fabricación de productos como jabones y detergentes.
- Los cristales iónicos, como el cloruro de potasio, se utilizan en la fabricación de sales de baño y productos farmacéuticos.
- Los compuestos iónicos también se utilizan en la industria de la alimentación como conservantes y aditivos.
- Enlaces covalentes:
- Los compuestos covalentes, como el agua y el dióxido de carbono, son fundamentales para la vida en la Tierra y se utilizan en una amplia gama de aplicaciones, desde la agricultura hasta la industria alimentaria.
- Los polímeros covalentes, como el polietileno y el PVC, se utilizan en la fabricación de plásticos, fibras textiles y productos químicos industriales.
- Los compuestos covalentes también se utilizan en la industria farmacéutica para la fabricación de medicamentos y productos químicos.
- Enlaces metálicos:
- Los metales y sus aleaciones se utilizan en la construcción de estructuras, vehículos, maquinaria y herramientas debido a su resistencia y maleabilidad.
- Los metales como el oro, la plata y el platino se utilizan en la fabricación de joyería y dispositivos electrónicos debido a su conductividad eléctrica y resistencia a la corrosión.
- Los compuestos metálicos, como el hierro y el aluminio, se utilizan en la fabricación de productos siderúrgicos, aluminio y acero inoxidable.
Comparación y contraste entre enlaces iónicos, covalentes y metálicos
Aunque los enlaces iónicos, covalentes y metálicos tienen algunas similitudes en términos de estabilidad y fuerza, también presentan diferencias significativas en sus propiedades y comportamiento:
- Los enlaces iónicos son fuertes y tienen altos puntos de fusión y ebullición, pero son frágiles y se rompen fácilmente cuando se exponen a fuerzas externas.
- Los enlaces covalentes son más débiles que los enlaces iónicos, pero son más flexibles y pueden adoptar una variedad de formas y estructuras moleculares.
- Los enlaces metálicos son los más fuertes y tienen la mayor conductividad eléctrica y térmica, pero también son los más maleables y dúctiles.

También te puede interesar...