Balanceo de ecuaciones químicas
Para poder hacer posible esta igualdad utilizamos coeficientes estequiométricos; los cuales son números enormes que colocamos por delante de los símbolos o fórmulas; esto es para indicar la cantidad de elementos que están interviniendo en el proceso de reacción química.
No se puede confundir los subíndices que llevan los símbolos o fórmulas; puesto que ellos indican por cuantos átomos está conformada la sustancia.
- Se debe considerar para hacer el correcto balanceo de una ecuación química.
- Tenemos que conocer las sustancias que reaccionan y sus productos.
- Los subíndices nos indicará la cantidad de átomos de cada molécula.
- Los coeficientes afectarán a toda sustancia que les preceda.
El oxigeno y el hidrógeno se deben equilibrar al final de la operación; puesto que estos generalmente forman H2O; es decir, agua y se consideraría una sustancia de relleno, por lo que, no alteraría la ecuación, ya que la reacción se estará realizando en una solución acuosa.
Ejemplo:
- Un ejemplo sencillo sería, 2 H2SO4.
- Esto quiere decir que tenemos 2 moléculas de ácido sulfúricos o dos moles de ácido sulfúrico.
- En cada una de las moléculas hay dos átomos de hidrogeno, uno de azufre y cuatro de oxígeno.
Existen varios métodos de balanceo para ecuaciones químicas, aquí vamos a explicar algunos.
Métodos para balanceo de ecuaciones químicas
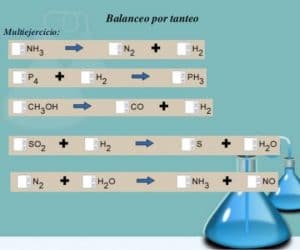
Balanceo por tanteo
N2 + H2 NH3
- Primero vamos a identificar las reacciones que intervienen; es decir nitrógeno e hidrógeno para la obtención del amoniaco.
- Verificamos si está o no balanceada la ecuación; este es el caso en que no lo está, lo que quiere decir que no poseen la misma cantidad de átomos.
- Para balancear vamos a colocar los coeficientes por delante de los símbolos o fórmulas que los necesiten. Empezamos con los metales o por el que se encuentre presente en sustancia menor.
- Primero haremos el balanceo del nitrógeno, es decir: N2 + H2 2 NH3
- Luego como habíamos mencionado, balanceamos de último el hidrógeno, nos quedaría: N2 + 3 H2 2 NH3.
Balanceo tradicional
En este caso explicaremos con este ejemplo: C3H8 + O2 à H2O + CO2.
Este es un tipo de reacción que ocurre cuando el C3H8 (propano) es expuesto ante el oxigeno y se quema, produciendo así agua y CO2.
Lo primero que haremos será escribir la cantidad de átomos por cada elemento que poseas a ambos lados de la ecuación.
Es decir, del lado izquierdo tenemos a:
- C = 3
- H = 8
- O = 2
Y del lado derecho a:
- C = 1
- H = 2
- O = 3
Como lo habíamos visto en el método anterior, dejamos el oxigeno e hidrógeno de últimos. Luego agregaremos el coeficiente al átomo de carbono que se encuentra en la derecha, esto es para hacer el balanceo con los otros 3 átomos de carbono ubicados a la izquierda de la ecuación.
C3H8 + O2 à H2O + 3CO2
Luego balanceamos los átomos de hidrógeno, como existen 8 del lado izquierdo, vamos a necesitar 8 del otro lado.
Así que: C3H8 + O2 à 4H2O + 3CO2
- Le hemos agregado 4 dado que el subíndice muestra que ya poseíamos 2 átomos y al multiplicarlos nos da 8.
- Los 6 átomos de oxígeno que vienen del 3CO2 quedarían con un resultado de 10, es decir 3 x 2 = 6 átomos de O2 + los otros 4 lo que nos da = 10.
- Finalmente balanceamos los átomos de oxígeno, ahora tenemos 4 átomos de oxigeno en las moléculas de H2O dado que la ecuación ha cambiado y 6 átomos de oxígeno en las moléculas de CO2. Teniendo una totalidad de 10 átomos de O2.
- Agregamos un coeficiente correspondiente a 5 en la molécula de O2 del lado izquierdo. Ahora ya tenemos 10 átomos de O2 de cada lado.
C3H8 + 5O2 à 4H2O + 3CO2
Te debería dar un resultado final del lado izquierdo y del lado derecho así:
- C= 3
- H= 8
- O= 10
De esta forma quedará balanceada la ecuación.

Vea también...