Los enlaces químicos son la interacción o fuerza de atracción que mantiene la unión de dos o más átomos que forman parte de una molécula y que se forman cediendo, ganando o compartiendo electrones para lograr estabilidad.
Esta estabilidad, es lograda por la unión de átomos, moléculas e iones, que utilizan electrones localizados en su capa más externa, es decir, que se mueven con facilidad entre un átomo y otro, se denominan electrones de valencia.
Los elementos químicos
Estructura de Lewis
A inicios del siglo xx, en el 1916, los científicos Walter Kossel y Gilbert Lewis, llegaron a la conclusión, de manera independiente, de que la formación de los enlaces químicos son explicados por la tendencia que poseen los átomos hacia lograr estructuras similares a la del gas noble más cercano.
Lewis, estableció los átomos logran ceder, ganar o compartir electrones al aproximarse unos con otros, de tal forma que en su última capa de valencia conserven una estructura de máxima estabilidad. Por lo que se establecen dos reglas:
- La regla del dueto: afirma que los átomos se unen y comparten electrones hasta que logran dos pares de electrones en su última capa de valencia.
- La regla del octeto: establece que los átomos se unen hasta conseguir su última capa de energía (de 8 electrones) adquiriendo la configuración electrónica del gas noble más próximo.
Los metales, por lo general, por su bajo nivel de electronegatividad ceden electrones, mientras que los no metales por su alto potencial de ionización y su elevada electronegatividad captan electrones.
Tipos de enlaces químicos
Los enlaces químicos se pueden clasificar dependiendo de su afinidad por los electrones y su configuración electrónica, encontrando:
- Enlace iónico: aquellos en los que los electrones de un átomo se transfieren a otro.
- Enlace covalente: el enlace donde los electrones son compartidos.
- Enlace metálico: cuando se unen entre sí dos o más átomos de elementos no metálicos.
Enlaces iónicos
Formados por la transferencia de electrones entre un metal y un no metal. 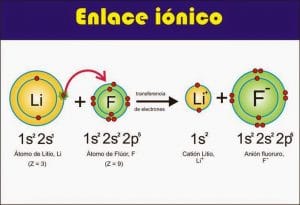
Si citamos el caso del cloro (Cl), por ejemplo, este posee 7 electrones, presenta una mayor predisposición hacia la atracción de electrones, en caso de atraer 1 tendría 8 electrones lo que lo convierte en un anión de cloruro–.
Tanto el cloro como el sodio, colocados en una solución acuosa, se transforman en cristales por sus cargas opuestas, las cuales atraen fuerzas electrostáticas.
Características
- No son conductores de electricidad en estado sólido. Puedes ver las características del estado sólido desde aqui.
- Debido a la presencia de iones móviles, conducen electricidad cuando se encuentran fundidos.
- Participan un catión y un anión.
- Por su fuerte atracción electrostática, por lo general, presentan puntos de fusión altos.
Ejemplos
- Fluoruro de Calcio (CaF2).
- Bromuro de Magnesio (MgBr2 ).
- Cloruro de calcio (CaCl2).
Enlaces covalentes
Aquellos que se dan cuando dos átomos comparten uno o más pares de electrones. Dependiendo de la electronegatividad de cada átomo, los electrones se desplazan entre ellos, pues no permanecen fijos.
Los enlaces covalentes se dividen en:
- Enlace covalente polar.
- Enlace covalente no polar.
Enlace covalente polar
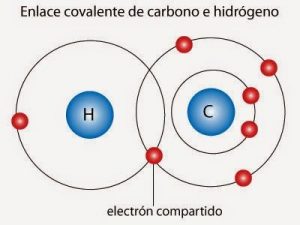
Enlace covalente no polar o puro
Aquellos donde la unión se da con dos elementos con el mismo nivel de electronegatividad y esta unión provoca que una de las partes obtenga o pierda electrones; los átomos son del mismo elemento.
Dependiendo de la cantidad de electrones que se comparten, pueden ser nombrados como:
- Enlace covalente simple: cuando un solo par de electrones es compartido.
- Enlace covalente doble: cuando se comparten 4 electrones.
- Enlace covalente triple: cuando comparte 6 electrones entres usa tomos.
Enlaces metálicos
Dados únicamente entre átomos metálicos de un mismo elemento. Es un enlace fuerte, con estructuras sólidas que junta los núcleos entre sí, haciéndolos deformables pero difíciles de romper. Los enlaces metálicos poseen electrones libres, por lo que se vinculan con la conductividad eléctrica propia de los metales.

