
Se presenta como un metal reactivo, suave y de muy bajo punto de fusión, con una valencia de 1, un estado de electronegatividad de 0.9 y de oxidación de +1, y con una configuración electrónica de 3s1.
La configuración electrónica del sodio
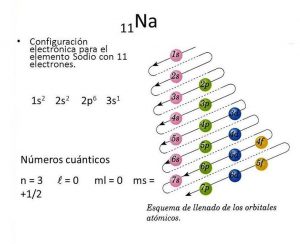
Para conocer la configuración electrónica del sodio, el cual posee 11 electrones, solo se debe de seguir sus diagonales, por ejemplo:
Se inicia con el 1s2, pero al no haber nada al seguir las diagonales se busca entonces la diagonal próxima que en este caso será el 2s2, al igual al no tener diagonales se busca una diagonal siguiente obteniendo así el 2p6, al seguir la diagonal se obtiene el 3s2.
Durante estos procesos siempre se debe de ir sumando los superíndices, los cuales mostrarán la cantidad de electrones. En este caso al sumar los superíndice el resultado será 12, o sea, hay un número de más, puesto a que debe de dar 11 para estar correcta, por ello se ha de corregir para que quede en 3s1.
En conclusión el sodio posee 11 electrones y su configuración electrónica se escribe de la siguiente forma: 1s22s22p63s1
Distribuyéndose cada electrón de la siguiente manera:
- 2 electrones para el primer nivel, o sea estarán los dos en subnivel s, dentro del orbital.
- 8 electrones en la segunda capa, de los cuales 2 estarán en el subnivel s y 6 en el subnivel p, y este último tendrá 2 electrones en sus 3 orbitales.
Este elemento químico llega a reaccionar con el agua para crear hidrógeno e hidróxido de sodio. Al estar el sodio metálico en contacto con el aire, llega a perder su color plateado y se torna con un tono gris opaco. A la vez nunca llega a reaccionar con el nitrógeno, aun estando frente a elevadas temperaturas.
Fue descubierto por Humphry Davy en el 1807, el cual lo aisló a través de la electrólisis de la soda cáustica. Este químico también descubrió otros elementos como es el calcio, el estroncio, el bario, el potasio, el magnesio y el boro. Se halla en los lagos salinos y en el mar como cloruro de sodio, representado con las letras: NaCl.
Isótopos de sodio.
El sodio posee trece isótopos, donde el único que es estable es el Na-23. También posee dos isótopos radioactivos cosmogénicos, el Na-24 y el Na-22, los cuales presentan períodos de semidesintegración de unos 2,605 años.
Características del sodio
- Su símbolo es Na.
- Su valencia es 1.
- Número atómico: 11.
- Tiene un primer potencial de 5,14 eV.
- Masa atómica 22,9898.
- Presenta un punto de fusión de 97,8 grados C, y de ebullición de 892 grados C.
- Posee una electronegatividad de unos 0.9.
- Tiene un radio covalente de 1,54, uno atómico de 1,9 y uno iónico de 0,95.
- Se llega a combinar con el oxigeno en temperaturas ambientes.
- Conduce muy bien la electricidad.
- Es un excelente conductor de electricidad.
- Considerado como un elemento muy activo.
- Reacciona de forma violenta con el agua.
- Se disuelve en mercurio formando así una amalgama de sodio.
- Es plateado, metálico, reactivo y suave.
- Presenta una densidad por debajo de la que posee el agua.
- Tiene una superficie brillante.
- Reacciona con ácidos creando hidrógeno gaseoso.

